
一节一号干电池烂在地里,能使1m2的土壤永久失去利用价值;一粒纽扣电池可使600t水受到污染,相当于一个人一生的饮水量.许多有识之士正在研究废旧电池的有效回收再利用技术.图1为干电池示意图.
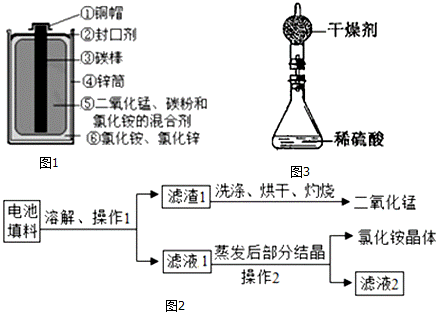
【物质归类】将回收的废干旧电池进行分离归类
(1)可以得到的单质有(用化学式表示,下同) ,
氧化物有 .
某化学兴趣小组回收利用废旧干电池并进行相关实验探究.
【实验探究1】回收填料中的二氧化锰和氯化铵
查阅资料:干电池示意图中⑤和⑥为填料,其中氯化铵、氯化锌可溶于水.兴趣小组的同学们设计回收物质的流程如图2所示.
(2)操作1和操作2的名称都是 ,该操作中玻璃棒的作用是 .
(3)灼烧滤渣l的目的是 .
【实验探究2】探究影响锌与稀硫酸反应快慢的因素
(4)反应过程中,用前10min内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表四组实验,获得数据如下表.
| 实验编号 | 试剂 | 前10 min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30 mL 30% | 564.3 |
| b | 含杂质的锌 | 30 mL 30% | 634.7 |
| c | 纯锌 | 30 mL 20% | 449.3 |
| d | 纯锌 | 40 mL 30% | 602.8 |
①比较实验a和实验b,可以得到的结论是 .
②为了研究硫酸浓度对反应快慢的影响,需比较实验 和实验 (填编号).
③控制其他条件相同,需控制的条件是 (例举一种条件即可).
【实验探究3】利用锌皮和稀硫酸制取氢气,并测定锌皮中锌的质量分数
(5)制取氢气的实验操作有:
a.收集气体;b.向锥形瓶里装锌皮;c.连接仪器,检查装置气密性;d.向长颈漏斗中注入稀硫酸;e.装配仪器.
正确的操作顺序为 .
(6)测定锌皮中锌的质量分数:已知该锌皮中含有少量杂质铁,将该锌皮放入如图3所示的盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如表:
| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌皮质量 | |
| 342.1g | 16g | 357.7g |
若不考虑干燥剂吸收空气中的水蒸气,请分析计算:
①根据质量守恒定律求生成氢气的质量为 g.
②该合金中锌的质量为 g,锌皮中锌的质量分数为 %.
| 混合物的分离方法;影响化学反应速率的因素探究;过滤的原理、方法及其应用;氢气的制取和检验;金属的化学性质;单质和化合物的判别;根据化学反应方程式的计算.. | |
| 专题: | 物质的分离和提纯;有关化学方程式的计算;科学探究. |
| 分析: | 【物质归类】根据物质的分类知识和单质、氧化物的定义回答. 【实验探究1】 (2)根据操作1分离混合物的状态及过滤可用于难溶性固体和可溶性固体的分离进行分析; (3)根据碳和氧气反应生成二氧化碳进行解答; (4)①通过表格比较实验的相同点和不同点得出结论; ②利用控制变量法分析自变量是硫酸的浓度,因变量是反应的快慢进行分析选择对比组; ③从外因寻找需要控制的条件:温度,颗粒大小等. 【实验探究3】 (5)本题考查实验室制取氢气的实验步骤,要注意先连接仪器再检查气密性,先加固体后加液体. (6)①根据锌和硫酸反应生成氢气而铜不反应,所以反应前后质量减少的质量就是氢气的质量进行解答; ②根据氢气的质量求出该合金中锌的质量以及该合金中锌的质量分数进行解答. |
| 解答: | 解:【物质归类】单质是由同种元素组成的纯净物,碳、锌、铜等符合定义;氧化物是由两种元素组成的,且其中一种元素为氧元素的化合物,二氧化锰符合定义; 【实验探究1】 (2)根据流程图操作1和2都是不溶性固体和液体的分离,因此是过滤操作,过滤时玻璃棒起到引流的作用; (3)因为废旧干电池填料的主要难溶性物质为二氧化锰、炭粉,因此溶解过滤后的滤渣含有二氧化锰和碳粉,而回收二氧化锰,因此通过灼烧可以把碳粉变成二氧化碳,因此灼烧滤渣l的目的是除去碳粉; (4)①实验a和实验b,相同点是同体积同浓度的稀硫酸,不同点是含杂质的锌和纯锌,结果含杂质的锌比纯锌反应速率要快; ②要研究硫酸浓度对反应快慢的影响,需要不同浓度的硫酸,而要控制锌的纯度相同,比较产生氢气的快慢,因此对比组是a和c; ③控制变量法需要考虑的是自变量和因变量,而其它外界条件均保存相同,因此控制其他条件相同,需控制的条件如;温度(或锌粒形状大小). 【实验探究3】(5)根据实验步骤中要先连接装置再检查装置的气密性,然后加药品时先固体后液体,再收集气体,则顺序为cbeda. (6)①依题意和质量守恒定律可得:氢气的质量=342.1g+16g﹣357.70g=0.4g ②设该合金中锌的质量为x. Zn+H2SO4═ZnSO4+H2↑ 65 2 x 0.4g 则 则该合金中锌的质量分数为 故答案为: 【物质归类】(1)Cu、C、Zn,MnO2. 【实验探究1】(2)过滤,引流.(3)除去炭粉. 【实验探究2】(4)①与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快.②a、c.③温度. 【实验探究3】(5)cbeda.(6)①0.4.②13,81.25. |
| 点评: | 化学来源于生产、生活,也服务于生产、生活,与生产、生活相关的化学知识是中考热点之一,要引起注意.在实验时要严格按照实验的步骤来完成,否则可能会导致实验的失败,同时注意培养学生具有严谨的科学思维方法. |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:初中化学 来源: 题型:
为探究物质的燃烧条件,某同学进行了如图所示的实验,下列有关说法正确的是( )
|
| A. | 现象①③说明白磷的着火点比红磷的着火点低 |
|
| B. | 现象①②说明物质的燃烧需要达到一定的温度 |
|
| C. | 现象②③说明物质燃烧需要氧气 |
|
| D. | 现象③说明红磷不是可燃物 |
查看答案和解析>>
科目:初中化学 来源: 题型:
合金是重要的金属材料.
(1)下列物品所使用的主要材料属于合金的是 (填字母,下同).
A.青花瓷茶杯 B.水银温度计 C.不锈钢水槽
(2)根据含碳量不同,铁的合金可分为生铁和 ,将生铁投入到盛有稀盐酸的试管中,表明反应已完全的现象是 ,试管中有黑色不溶物是 .
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻划(如图1所示),纯铜片上留下明显的划痕,说明 .
(4)黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如图2(杂质不溶于水、不参与反应):

已知:ZnO+H2SO4═ZnSO4+H2O;CuO+H2SO4═CuSO4+H2O.
下列说法正确的是 .
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4 的质量大于CuSO4
c.溶液A的质量小于溶液B.
查看答案和解析>>
科目:初中化学 来源: 题型:
温室效应增强严重影响了人类和其他生物的生存,二氧化碳是造成温室效应增强的气体之一,生活中你怎样“低碳”生活?谈四点措施。
(1) (2) (3) (4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com