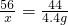在实验室里,亮亮同学想制取少量的氢氧化钠溶液,但是,他发现药品柜中只有一定量的碳酸钠溶液和12.5g石灰石固体;因此,他首先煅烧此石灰石(煅烧时假设杂质没有变化,且所含有的杂质不溶于水也不与水反应),充分反应后冷却,称量最后固体质量为8.1g,将此固体放入足量的水中最后得固液混合物,然后将此固液混合物加入一定量的碳酸钠溶液中,可恰好反应,然后过滤,得滤液的质量为200g.请回答下列问题:
(1)亮亮所做的实验中生成氢氧化钠的化学方程式为______;
(2)煅烧石灰石过程中生成二氧化碳的质量为______ g;
(3)在亮亮的实验中,列出求解生成氧化钙质量(x)的比例式______;
(4)实验中所用石灰石的纯度为______;
(5)最后亮亮同学所制取的氢氧化钠溶液的溶质质量分数为______.
解:(1)根据题意可以知道,碳酸钠可以和氢氧化钙反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:Ca(OH)
2+Na
2CO
3═CaCO
3↓+2NaOH;
(2)根据质量守恒定律反应前后固体减少的质量为生成的二氧化碳的质量,所以生成二氧化碳的质量为:12.5g-8.1g=4.4g;
(3)设生成氧化钙的质量为x,石灰石中碳酸钙的质量为y
CaCO
3
CaO+CO
2↑
100 56 44
y x 4.4g
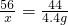

解:x=5.6g,y=10g
(4)石灰石的纯度为:

×100%=80%;
(5)设生成氢氧化钠的质量为z,由CaO+H
2O═Ca(OH)
2Ca(OH)
2+Na
2CO
3═CaCO
3↓+2NaOH
可得:CaO-2NaOH
56 80
5.6g z

解得:z=8g
所制取的氢氧化钠溶液的溶质质量分数为:
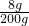
×100%=4%.
故答案为:(1)Ca(OH)
2+Na
2CO
3═CaCO
3↓+2NaOH;
(2)4.4;
(3)
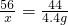
(4)80%;
(5)4%.
分析:(1)根据题意可以知道,碳酸钠可以和氢氧化钙反应生成碳酸钙和氢氧化钠,可以据此写出该反应的化学方程式;
(2)根据质量守恒定律反应前后固体减少的质量为生成的二氧化碳的质量,可以据此解答该题;
(3)根据碳酸钙分解的化学方程式可以结合生成的二氧化碳的质量可以列出比例式;
(4)根据二氧化碳的质量结合碳酸钙分解的化学方程式可以计算出碳酸钙的质量,进而计算出石灰石的纯度;
(5)根据反应生成的氧化钙和水的反应以及氢氧化钙和碳酸钠反应的化学方程式可以得出氧化钙的和氢氧化钠的关系式,然后作出解答即可.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

 CaO+CO2↑
CaO+CO2↑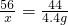

 ×100%=80%;
×100%=80%;
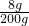 ×100%=4%.
×100%=4%.