
我国制碱工业的先驱——侯德榜探索发明了“侯氏制碱法”,其生产过程涉及的主要化学反应如下:
①NH2+CO2+X=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3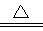 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
请回答下列问题:
(1)反应①中X的化学式为 。
(2)除去混在Na2CO3粉末中少量的NaHCO3的方法是 。
(3)工业纯碱中含有氯化钠,取55g工业纯碱,向其中加入269.5g稀盐酸,恰好完全反应,生成22g二氧化碳,求:
①工业纯碱中碳酸钠的质量分数。(计算结果保留到0.1%)
②反应后溶液中溶质的质量分数。
(1) H2O 。(2)将混合物加热。
(3)①55g工业纯碱中碳酸钠的质量为96.4%;
②反应后溶液中溶质氯化钠的质量分数为20%
解析试题分析:(1)根据反应前后原子的种类及个数不变可知, X的化学式为H2O。
(2)NaHCO3在加热的情况下可反应生成碳酸钠,所以可以用将混合物加热的方法。
(3)根据题意可知:反应为碳酸钠与盐酸反应生成氯化钠,水和二氧化碳气体;已知量为二氧化碳的质量;未知量为①工业纯碱中碳酸钠的质量分数、②反应后溶液中溶质的质量分数。解题思路:1、可根据反应化学方程式中二氧化碳与碳酸钠的质量关系,求出碳酸钠的质量;再进一步求出其质量分数。2、可根据反应化学方程式中二氧化碳与氯化钠的质量关系,求出生成氯化钠的质量;再结合样品质量求出样品中氯化钠的质量,即可计算所得溶液的溶质质量分数。具体过程如下:
解:设①55g工业纯碱中碳酸钠的质量为x,②反应后生成氯化钠的质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 22g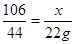
x=53g
工业纯碱中碳酸钠的质量分数为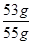 ×100%=96.4%
×100%=96.4%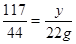
y=58.5g
则反应后溶液中溶质氯化钠的质量分数为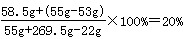
答:①工业纯碱中碳酸的质量分数为96.4%。②反应后溶液中溶质的质量分数为20%。
考点:综合计算


科目:初中化学 来源: 题型:单选题
氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反应的化学方程式为:2N2+6H2O 4NH3+3O2。计算生产34t NH3所需N2的质量。
4NH3+3O2。计算生产34t NH3所需N2的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,向其中加入57.9g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:
(1)小明要从反应后的溶液中提取NaCl应采用的方法是 ;
(2)纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
(3)反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(13分)医学上经常用硫酸亚铁糖衣片给贫血患者补铁。某兴趣小组的同学对糖衣片中硫酸亚铁晶体的制备和组成产生了兴趣并对其进行探究。
探究Ⅰ:利用实验室的废水回收铜、制备硫酸亚铁晶体。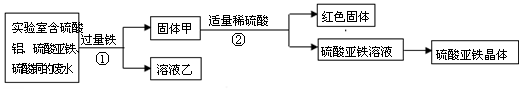
(1)步骤①的化学方程式是 。
(2)固体甲中含有的物质是 (填化学式,下同) ;红色固体是 ;溶液乙中的溶质是 。
探究Ⅱ:硫酸亚铁晶体(FeSO4?xH2O)的化学式。
【查阅资料】
(1)无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体。
(2)硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物。
【进行实验】
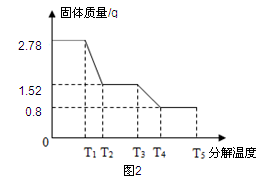
该兴趣小组同学称取2.78g硫酸亚铁晶体(FeSO4?xH2O)样品按图1装置高温加热,使其完全分解,并对所得产物进行分析,并利用SDTQ600热分析仪对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示关系图。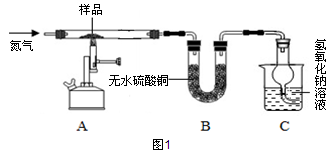
【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,说明产物中有 ,该物质的质量为 g。
(2)T3℃时,发生的化学反应为:2FeSO4高温Fe2O3+X↑+SO3↑,其中X的化学式
。
(3)装置C中氢氧化钠溶液的作用是 。
(4)已知FeSO4?xH2O △FeSO4 + xH2O;
计算FeSO4?xH2O中的x。(写出计算过程)
【交流讨论】实验中要持续通入氮气,否则测出的x值会 (填偏大、偏小或不变)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(11分)煤、石油和天然气等化石燃料是目前人类使用的最主要燃料,也是重要的化工原料。
(1)石油中主要含有 两种元素(填写元素符号);天然气的主要成分是 (填写化学式)。
(2)化石燃料属于 (选填“可再生”或“不可再生”)能源,其燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式: KAlSi3O8+CO2+2H2O==KHCO3+X+3SiO2↓,则X的化学式为 。
(3)工业上,煤炭燃烧前进行粉碎的目的是 。煤隔绝空气加强热得到的焦炭,是冶铁的重要原料。为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应)。
方案I 取8.00g赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60g滤渣。则赤铁矿粉中氧化铁的质量分数为 。
方案Ⅱ 如图所示,取8.00g赤铁矿粉与过量的焦炭粉混合后加强热,充分反应。测得氢氧化钠溶液反应前后质量增加了1.32g。如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应3C+2Fe2O3△4Fe+3CO2↑计算,赤铁矿粉中氧化铁的质量分数为 。
[实验反思]方案Ⅱ中硬质玻璃管内原有的空气对实验结果有影响,这会导致测出的氧化铁的质量分数 (选填“偏大”、“偏小”或“不变”)。
[实验分析]方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是 (写出一种即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图像分析回答下列问题:
原废液中的溶质成分有 用化学式回答)。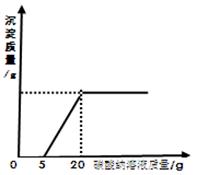
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(12分)某氢氧化钙中含有碳酸钙杂质,称取研细的该样品12.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如下表所示.
| 加入盐酸的质量/g | 0 | 25 | 37.5 |
| 锥形瓶中物质的质量/g | 45 | 70 | 80.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒人8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验。
若停止实验时,两溶液恰好反应。请分析小明实验后回答:
(1)实验中酚酞试剂的作用是_________________________;
(2)计算出这时共用去稀盐酸的质量是多少?(精确到0.1
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7 分)盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法。农业生产上常用质量分数 15%—20%的氯化钠溶液来选种。为了测定某氯化钠溶液是否符合要求,取该溶液70g,加入一定溶质质量分数的 AgNO3溶液 100g,恰好完全反应,过滤分离出沉淀的质量为28.7g。
(1)在配制氯化钠溶液的操作过程中,溶解时需要用到玻璃棒,其作用是 。
(2)反应后所得溶液的质量为 g。
(3)通过计算确定该氯化钠溶液是否符合选种要求?(计算结果精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com