
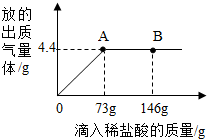
 在一烧杯中盛有22.3g碳酸钠和氯化钠组成的固体混合物,加足量水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:请根据题意回答问题:
在一烧杯中盛有22.3g碳酸钠和氯化钠组成的固体混合物,加足量水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:请根据题意回答问题:分析 (1)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行分析;
(2)根据溶液在加水稀释前后溶质的质量不变,利用溶质质量=溶液质量×溶质质量分数即可求得需质量分数为36%的浓盐酸的质量;
(3)欲知烧杯中溶液里的溶质,须知此时是否完全反应,反应物是否剩余,再判断溶液中的溶质有哪些物质;
(4)根据化学方程式,得到各物质之间的比例式,求出各物质的量,再根据溶质质量分数公式进行计算.
解答 解:(1)Na2CO3中钠元素与氧元素的质量比为(23×2):(16×3)=23:24;
(2)设需质量分数为36%的浓盐酸的质量为x,
则根据溶液在加水稀释前后溶质的质量不变,可得:
146g×10%=x×36%;
解得:x=40.6g;
(3)因到A点时已完全反应,故到B 点时盐酸有剩余,故烧杯中溶液里的溶质有NaCl、HCl;
(4)73g10%的稀盐酸中含HCl的质量是:73g×10%=7.3g
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y.设放出气体的总质量为z.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 73 117 44
x 7.3g y z
$\frac{106}{x}$=$\frac{73}{7.3g}$
解之得x=10.6g
$\frac{73}{7.3g}$=$\frac{117}{y}$
解之得y=11.7g
得$\frac{73}{7.3g}$=$\frac{44}{z}$,
解之得z=4.4g
烧杯里不饱和溶液中溶质的质量为:11.7g+(22.3g-10.6g)=23.4g
烧杯里不饱和溶液质量为:22.3g+73g-4.4g=90.9g
烧杯里不饱和溶液中溶质的质量分数为:$\frac{23.4g}{90.9g}$×100%=25.7%
答:其中溶质的质量分数为25.7%.
故答案为:(1)23:24;
(2)40.6g;
(3)NaCl、HCl;
(4)25.7%.
点评 本题要求学生熟悉完全反应的特点,能正确理解溶液和溶质的关系,熟练运用溶质的质量分数进行计算,才能正确答题.


科目:初中化学 来源: 题型:解答题
 某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.
某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | BaCl2、Na2CO3 | B. | KNO3、HCl | C. | Na2CO3、HCl | D. | Na2CO3、KNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 所取石灰石样品的质量/g | 22 | 22 | 22 | 22 | 22 |
| 加入盐酸的质量/g | 20 | 40 | 60 | 80 | 100 |
| 烧杯内剩余物的质量/g | 39.8 | 57.6 | 75.4 | 93.2 | 93.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 山西面食享誉天下,今天的午饭妈妈为小东准备了西红柿鸡蛋面.
山西面食享誉天下,今天的午饭妈妈为小东准备了西红柿鸡蛋面.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com