

分析 (1)①根据装置图来判断反应物状态和药品;
②根据不需要加热可知能制取二氧化碳,且根据二氧化碳的性质来考虑本题;
③根据二氧化碳不支持燃烧来考虑.
(2)甲试管中氢氧化钠溶液进入并充满试管,说明氢氧化钠被消耗掉,丙试管中液体进入试管体积的一半,结合甲试管和丙试管中的现象联系二氧化碳的性质可以完成该题的解答.
解答 解:(1)①根据装置特点可知反应不需要加热,所以制取氧气用过氧化氢和二氧化锰,分液漏斗中放的是液体过氧化氢溶液,小试管中放的药品是二氧化锰;由于反应物是过氧化氢,生成物是水和氧气,反应条件是二氧化锰作催化剂,用观察法配平即可;
②若小想到制取二氧化碳,试管中装有大理石,稀盐酸与碳酸钙反应,分液漏斗中盛放的是稀盐酸,石灰石(主要成分碳酸钙)与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.二氧化碳的性质有:能使澄清石灰水变浑浊,能与水结合生成碳酸使紫色石蕊试液变红,既不能燃烧也不支持燃烧,所以验证性质时用到澄清石灰水、滴有紫色石蕊试液的水;
③由于二氧化碳既不能燃烧也不支持燃烧,所以用燃着的木条来看是否能熄灭即可.
(2)甲试管氢氧化钠溶液进入并充满试管,说明氢氧化钠溶液可以和二氧化碳反应,丙试管中液体进入试管体积的一半,说明二氧化碳和消耗氢氧化钠溶液的体积为1:1,而乙试管中的A气体氢氧化钠溶液未进入,说明氢氧化钠没有被消耗掉,也就是没有反应.即A气体不与氢氧化钠溶液反应(或不与氢氧化钠、水、二氧化碳反应).
故答案为:(1)①过氧化氢溶液;二氧化锰;2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②稀盐酸;石灰石;CaCO3+2HCl═CaCl2+H2O+CO2↑.滴有紫色石蕊试液的水;CO2+H2O═H2CO3;
③将一根燃着的木条放在K处;
(2)不溶于水,不与NaOH反应;
点评 通过回答本题知道了实验室制取二氧化碳所用的装置图、二氧化碳的性质和验证性质的方法.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:初中化学 来源: 题型:实验探究题

| 小组 | 取用石灰石样品质量 | 测得CO2的质量 | 碳酸钙的质量分数 |
| ① | 1.0g | 0.46g | 104% |
| ② | 2.0g | 0.80g | 91% |
| ③ | 2.5g | 1.0g | 93% |
| ④ | 3.0g | 1.2g | 92% |
| ⑤ | 4.0g | 1.5g | 85.7% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
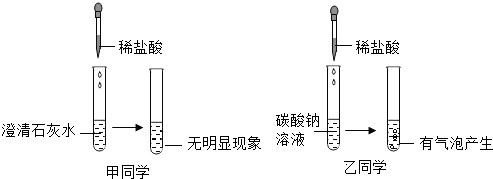
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | YX | B. | Y2X | C. | YX2 | D. | XY |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某兴趣小组用图所示装置收集并测量反应产生的气体及其体积.
某兴趣小组用图所示装置收集并测量反应产生的气体及其体积.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com