
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法不正确的是( )
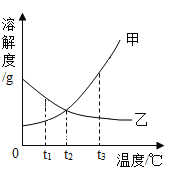
A. 甲的溶解度大于乙的溶解度
B. t1℃时,甲、乙的饱和溶液的溶质质量分数不相等
C. t2℃时,乙物质的饱和溶液降温至 t1℃时会转化为不饱和溶液
D. 当甲中含有少量乙时,可采用降温结晶的方法提纯甲
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】将质量为44.4克含有少量NaCl 的纯碱晶体(Na2CO3nH2O)样品,平均分成A、B、C三份,进行如图实验(Na2CO3受热不分解)。
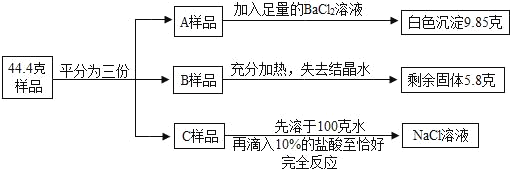
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是_____。
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是_____克。
(3)B样品中含有结晶水的质量是_____克。
(4)化学式Na2CO3nH2O中n是_____
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少_____?(精确到0.01%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下水道堵塞是日常生活中经常遇到的问题,下水管里的淤积物主要为油污、食物残渣、毛发等。“管道通”可使堵塞的管道畅通无阻。化学兴趣小组对“管道通”中的物质进行了探究:

(查阅资料)
(1)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
(2)铝粉呈银白色。铝粉与强酸、强碱溶液都能迅速反应放出氢气,同时放出大量热。
①铝与盐酸反应的化学方程式为_____。
②铝与氢氧化钠溶液反应的化学方程式为_____=2NaAlO2+3H2↑
(1)(猜想与验证)打开一盒“管道通”,内有一袋白色固体颗粒和一袋银白色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
实验操作 | 实验现象 |
①将几粒白色颗粒放在表面皿上,露置在空气中片刻。 | _____ |
②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 | 试管外壁温度升高 |
③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 | 羊毛线缩小 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银白色粉末为铝粉。
实验操作 | 实验现象 |
①取少量该粉末于洁净的试管中,滴加稀盐酸,用手触摸 试管外壁,点燃反应产生的气体 | 产生大量气泡,试管外壁温度明显升高,气体燃烧产生淡蓝色火焰。 |
②取少量该粉末于洁净的试管中,滴加_____,用手触摸 试管外壁,点燃反应产生的气体 |
结论:银白色粉末为铝粉。
(应用)
(2)使用“管道通”时,先将银白色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口。管道内可能出现的现象是_____.(填序号)
A.管道内温度明显升高
B.产生大量气体
C.管道被疏通
(3)“管道通”内的两种物质必须密封保存,否则会发生变质。用化学方程式表示其中的原因:_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线。
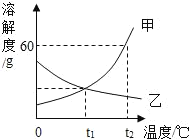
(1)在温度为_____℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,通过升温的方法能将接近饱和的溶液变为饱和溶液的是_____;
(3)t2℃时,将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数为_____(精确到0.1%);
(4)用一定的方法,将乙的不饱和溶液变为饱和溶液,下列说法正确的是_____。
a溶剂的质量可能不变
b溶质质量分数一定变大
c溶液的质量可能不变
d溶质的质量一定变大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.
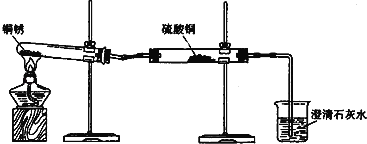
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 ; 铜绣由 元素组成; 烧杯中发生反应的化学方程式为 . |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是
|
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
(一)以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
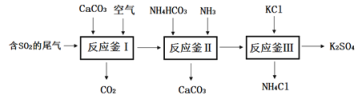
⑴钾肥K2SO4对农作物生长的作用是___________。
A.促进植物茎、叶生长,使叶色浓绿;
B.增强植物的抗寒、抗旱能力
C.增强植物的抗病虫害、抗倒伏能力
⑵反应釜I中发生的反应包括:①碳酸钙高温分解的化学方程式为________;
②CaO + SO2==CaSO3 ③ 2CaSO3+O2==2CaSO4
⑶反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为____________(填字母序号,如图为几种盐的溶解度曲线)。
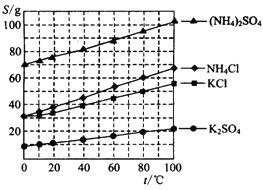
A.0℃-10℃ B. 20℃-30℃ C. 60℃-65℃ D. 80℃-90℃
⑷上述工艺流程中循环利用的物质是_______;证明产品K2SO4中不含杂质的实验方法是_______写出方法、现象)。
(二)实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
(步骤I)制备MnSO4溶液:在三颈烧瓶中(装置见图) 加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
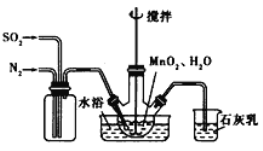
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
⑸烧杯中石灰乳(有效成分为氢氧化钙)的作用为________。
⑹三颈烧瓶中生成MnSO4的反应化学方程式为____________。
⑺步骤I中,先通入氮气的目的是_________。为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:及时搅拌反应液、_______(任写1条)。
(步骤II)制备MnSO4H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4H2O晶体。
(步骤III)制备Mn3O4固体:准确称取101.4mg MnSO4H2O,将MnSO4H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
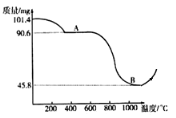
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4又被氧气氧化为Mn2O3或MnO2
⑻该曲线中A段所表示物质的化学式为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了酸和碱的化学性质后,实验小组的同学利用氢氧化钠与稀硫酸进行实验,反应的化学方程式_____,同学们对反应后溶液中的溶质成分产生了兴趣,请你与他们一起进行以下探究。
(提出问题1)溶液中的溶质是什么物质?
(进行猜想1)(1)甲同学认为溶液中的溶质只有Na2SO4。
(2)乙同学认为溶液中的溶质是Na2SO4和H2SO4
(3)丙同学认为溶液中的溶质是Na2SO4和NaOH
(查阅资料)Na2SO4溶液显中性。
(实验验证1)实验操作①:取少许反应后的溶液于试管中,将打磨光亮后的铝片放入试管的溶液中。观察到铝片逐渐溶解,并有大量气泡冒出。实验结论:猜想(2)成立。
实验操作②:取少许反应后的溶液于试管中,向试管中滴加几滴无色酚酞溶液。观察到溶液变成_____色。实验结论:猜想(3)成立。
(反思交流)(1)打磨铝片的目的是_____。
(2)对于实验出现不同的结论,同学们咨询老师后得知:铝与氢氧化钠反应也会有气体产生,经过讨论,同学们一致认为反应后的溶质由_____(写化学式)组成。
(提出问题2)铝与氢氧化钠反应生成的气体可能是什么?
(进行猜想2)同学们认为产生的气体可能是氢气,一定不是CO 2,原因是_____。
(实验验证2)实验小组的同学们设计如图所示实验装置检验生成的气体后,验纯后点燃气体,观察到_____,证明反应生成的气体是氢气。
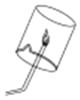
(知识拓展)生活中能否用铝制品来盛放强碱性溶液?_____(填“能”或“不能”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。请计算:
第一次 | 第二次 | 第三次 | 第四次 | |
加入澄清石灰水的质量/g | 100 | 100 | 100 | 100 |
生成沉淀的质量/g | 0.4 | m | 1.0 | 1.0 |
(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,然后再用废液测定一瓶未知浓度的Na2CO3溶液的溶质质量分数,他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
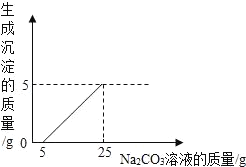
(1)横坐标上0~5这一段所表示的意义是_____。
(2)计算Na2CO3溶液中溶质的质量分数_____。(计算结果精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com