
| ʵ����� | 1 | 2 | 3 |
| ����ϡ���������/g | 48 | 49 | 50 |
���� ����������ϡ���ᷴӦ���������ƺ�ˮ����3��ʵ�����ĵ�ϡ�����ƽ��ֵ����ϡ���������ʵ������������ɷ�Ӧ�Ļ�ѧ����ʽ��ʽ��������ĵ��������Ƶ���������������������������Ƶ�����������
��� �⣺��1��ʵ��������ˮǡ����ȫ��Ӧ����Ҫ��ϡ���������Ϊ��48g+49g+50g����3=49g��
��2������ˮ�������������Ƶ�����Ϊx
2NaOH+H2SO4�TNa2SO4+2H2O
80 98
x 49g��20%
$\frac{80}{98}=\frac{x}{49g��20%}$ x=8g
��ˮ�������������Ƶ���������Ϊ$\frac{8g}{80g}$��100%=10%��
�𣺣�1��49����2����ˮ�������������Ƶ���������Ϊ10%��
���� �����ѶȲ����������û�ѧ����ʽ�����������������ۺϼ��㼴����ȷ����⣬����ʱҪע�����Ĺ淶�ԣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ѡ�� | ���ʣ�������Ϊ���ʣ� | ��ȥ���ʵķ��� |
| A | NaOH��Һ��Na2CO3�� | ����������Ca��OH��2��Һ������ |
| B | CaO��CaCO3�� | ��ˮ�ܽ⡢���� |
| C | CO��CO2�� | ͨ��������NaOH��Һ������ |
| D | FeSO4��H2SO4�� | ������������ۣ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ������Ƥ�� | B�� |  ��ȡһ��������ʳ�� | ||
| C�� |  ���Թ��еμ�Һ�� | D�� |  ���װ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
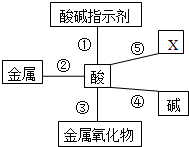 ����֪ʶ�����ܰ�����������֪ʶ���������ϵ���������ͼ��Ļ�ѧ����֪ʶ���磬����������⣺
����֪ʶ�����ܰ�����������֪ʶ���������ϵ���������ͼ��Ļ�ѧ����֪ʶ���磬����������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
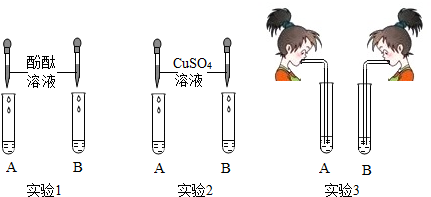
| ʵ�� | ʵ������ | ���� |
| ȡB��������Һ���������ʯ��ˮ�����ٲ�������Ϊֹ�����˺�ȡ�ϲ���Һ�������мӼ��η�̪��Һ�� | ������ɫ���� ��Һ���ֺ�ɫ | ����3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
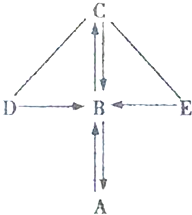 ��ͼ��ʾ��A��B��C��D��E�dz��л�ѧ���������ֲ�ͬ�������ʣ�������Ԫ�أ�����AΪ���ʣ�D�ڹ�ҵ�п������ڳ��⣻ͼ�С�һ����ʾ���������ʿ��Է�����Ӧ����������ʾ-��������������һ�����ʣ����ַ�Ӧ������P��Ӧ����ʡ�ԣ���
��ͼ��ʾ��A��B��C��D��E�dz��л�ѧ���������ֲ�ͬ�������ʣ�������Ԫ�أ�����AΪ���ʣ�D�ڹ�ҵ�п������ڳ��⣻ͼ�С�һ����ʾ���������ʿ��Է�����Ӧ����������ʾ-��������������һ�����ʣ����ַ�Ӧ������P��Ӧ����ʡ�ԣ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����
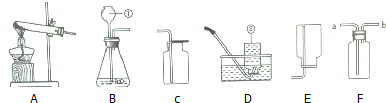
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com