某化学兴趣小组提出可以用含铜废料制备蓝色胆矾(CuSO
4?XH
2O).查阅资料:
Ⅰ.过氧化氢常温下会缓慢分解为氧气和水.对其水溶液加热、光照或加催化剂(如MnO
2)都促进其分解.
Ⅱ.CuSO
4?XH
2O易溶于水难溶于酒精,加热时会逐步失去结晶水,最终生成CuSO
4.
Ⅲ.白色粉末CuSO
4易与水化合生成CuSO
4?XH
2O
I.酸铜晶体的制备
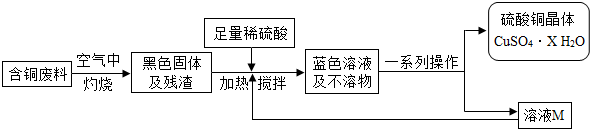
方案1:毛毛同学根据已学知识,提出了制备硫酸铜方案:
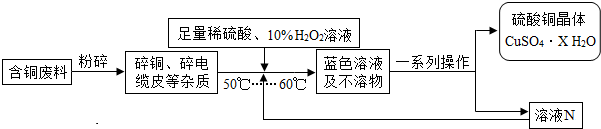
方案2:方舟同学查阅资料归纳了一种工业制备硫酸铜的流程:
(1)上述方案1中加热搅拌的作用是
,形成蓝色溶液的化学反应方程式是:
.
(2)方案2中,加入H
2O
2后要求温度控制在50℃到60℃是为了防止
.
(3)从环保角度对两套方案的不同部分进行比较,你认为方案
(填1或2)更合理.理由是
.
(4)方案中“一系列操作”依次为:过滤、
、冷却结晶、
(填序号).
A.蒸发浓缩 B.加水稀释 C.加水溶解 D.过滤
(5)溶液M、N都是CuSO
4的
(选填a“饱和”、b“不饱和”或c“不一定饱和”)溶液.
(6)所得硫酸铜晶体需要洗涤后晾干,最合适的洗涤试剂是
.
A.冷蒸馏水 B.95%的酒精 C.热蒸馏水
Ⅱ.酸铜晶体(CuSO
4?xH
2O)中结晶水(xH
2O)含量测定学习小组取12.5g硫酸铜晶体(CuSO
4?xH
2O)进行加热分解,获得相关数据,并绘制成固体质量与温度的关系图.
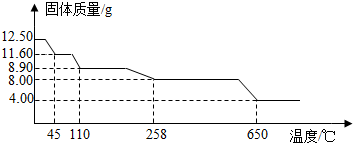
(7)258℃时,固体完全变成白色粉末.根据图中数据,计算CuSO
4?xH
2O中x的值为
.
加热过程中,硫酸铜晶体分步失去结晶水.请写出45℃到110℃时反应方程式:
.
(8)580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
.






 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案

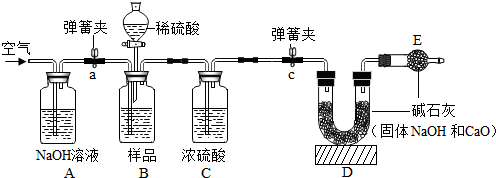
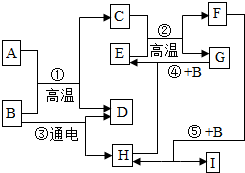 如示某些物质间转化关系.其中A、E、G为固体,且A、G均为单质,E为红棕色固体,G为常见金属;C、F、D、H为无色气体,其中C、F是由相同元素组成的无色气体,且C有毒;B为常见的无色液体,I为有机物.请回答下列问题:
如示某些物质间转化关系.其中A、E、G为固体,且A、G均为单质,E为红棕色固体,G为常见金属;C、F、D、H为无色气体,其中C、F是由相同元素组成的无色气体,且C有毒;B为常见的无色液体,I为有机物.请回答下列问题: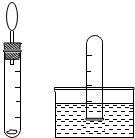 小刚在化学课上学习了《空气中氧气含量的探究实验》的内容后,非常感兴趣,课后他设计了一套简易装置继续进行探究:将橡皮塞塞紧后的试管体积5等分,做好标记.在试管中加入一小块白磷,用橡皮塞塞紧试管口;等白磷燃烧熄灭后,将试管倒立于盛有水的水槽中(如图),并在水下将橡皮塞取下.请你根据他的探究回答下列问题.
小刚在化学课上学习了《空气中氧气含量的探究实验》的内容后,非常感兴趣,课后他设计了一套简易装置继续进行探究:将橡皮塞塞紧后的试管体积5等分,做好标记.在试管中加入一小块白磷,用橡皮塞塞紧试管口;等白磷燃烧熄灭后,将试管倒立于盛有水的水槽中(如图),并在水下将橡皮塞取下.请你根据他的探究回答下列问题.