
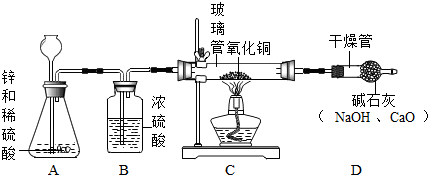
分析 【设计方案】根据锌与稀硫酸的反应写出装置A中发生反应的化学方程式,根据浓硫酸具有吸水性分析浓硫酸的作用;
【实验探究】根据在加热的条件下氢气与氧化铜的反应,分析实验过程中观察到C中的实验现象,根据氧化铜减少的质量和碱石灰增加的质量进行分析;
【问题讨论】根据碱石灰能吸收空气中的水分、二氧化碳等分析;
【分析交流】根据玻璃管中固体减少的质量就是生成的水中氧元素的质量,红色固体a中含有Cu2O不影响对水的测定结果进行分析;
【提出猜想】根据氧化铜被还原的生成物进行猜想.
【定量分析】根据化学方程式和题中的数据,通过计算可以确定红色固体a的成分
解答 解:【设计方案】由装置图可知,装置A中锌与稀硫酸反应生成了硫酸锌和氢气,发生反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑,由于浓硫酸具有吸水性,洗气瓶B中浓硫酸的作用为干燥气体.
【实验探究】由于在加热的条件下,氢气还原氧化铜生成了铜和水,所以,实验过程中观察到C中黑色固体变为红色,通过题中的数据可知,装置C的玻璃管和其中固体的总质量在反应后减少了1.6g,理论上为水中氧元素的质量,装置D的干燥管和其中物质的总质量在反应后增加了1.82g即为水的质量,用此数据算得水中H、O元素的质量比为(1.82g-1.6g):1.6g=11:80.
【问题讨论】由于碱石灰能吸收空气中的水蒸气和二氧化碳,该装置存在缺陷,对此改进的方法是:在D装置的后面,再连接一个D装置,防止空气中的水蒸气、二氧化碳对实验造成干扰.
【分析交流】红色固体a中含有Cu2O不影响水测定结果,因为玻璃管中固体减少的质量就是生成的水中氧元素的质量,和固体的成分无关;
【提出猜想】由于CuO被还原的过程中会有Cu2O生成,Cu2O固体是红色的,Cu2O也能被还原成Cu;所以,猜想②是:Cu2O.
【定量分析】①设生成铜的质量为x,则
Cu2O+H2SO4=CuSO4+Cu+H2O
144 64
3.6g x
$\frac{144}{64}=\frac{3.6g}{x}$ 解得:x=1.6g
②由于1.6g<2g,红色固体中一定含有Cu2O和Cu,故猜想①成立.
故答为:【设计方案】Zn+H2SO4=ZnSO4+H2↑,干燥气体;
【实验探究】黑色固体变为红色,11:80;
【问题讨论】在D装置的后面,再连接一个D装置,防止空气中的水蒸气对实验造成干扰
【分析交流】不影响;
【提出猜想】Cu2O;
【定量分析】①生成铜的质量为1.6g;②由于1.6g<2g,红色固体中一定含有Cu2O和Cu,故猜想①成立.
点评 通过计算可以确定物质的组成,这是近年来常考的内容之一,既是重点、又是难点,要仔细领会、全面掌握.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质(少量) | 除去杂质的方法 |
| A | O2 | 水蒸气 | 通过NaOH溶液 |
| B | 铁粉 | 硫酸铜 | 溶解,过滤,洗涤、干燥 |
| C | NaCl溶液 | Na2CO3 | 加入适量的稀HCl |
| D | CO2 | CH4 | 通入O2点燃后,再经过浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁能和稀硫酸、CuSO4溶液、Cu(OH)2发生置换反应 | |
| B. | NaOH能和盐酸、CuSO4溶液、K2SO4溶液反应 | |
| C. | 用过量的CaO除去CaCl2溶液中的盐酸 | |
| D. | 借助酚酞试液可完成稀盐酸、NaCl溶液、NaOH溶液、K2CO3(草木灰的主要成分)溶液间的鉴别 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 每1个C原子和1个O2分子反应,生成2个CO2分子 | |
| B. | 32g S与32g O2完全反应,生成64g SO2 | |
| C. | 镁条燃烧后固体质量增加,故质量守恒定律不是普遍规律 | |
| D. | 根据:蜡烛+氧气$\stackrel{点燃}{→}$二氧化碳+水,则蜡烛中一定含有C、H、O三种元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
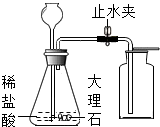 如图是实验室制取二氧化碳的一种装置.请回答下列问题:
如图是实验室制取二氧化碳的一种装置.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com