
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
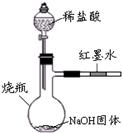
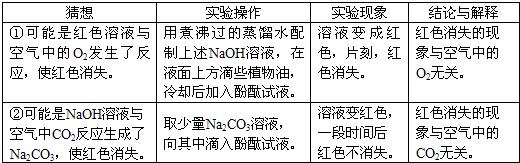
查看答案和解析>>
科目:初中化学 来源:2013届江苏省泰州市永安初级中学九年级下学期第二次涂卡训练化学试卷(带解析) 题型:问答题
某化学兴趣小组提出可以用含铜废料制备蓝色胆矾(CuSO4·XH2O)。
查阅资料:
Ⅰ 过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2)都会促进其分解。
Ⅱ CuSO4·XH2O易溶于水难溶于酒精,加热时会逐步失去结晶水,最终生成CuSO4。
Ⅲ 白色粉末CuSO4易与水化合生成CuSO4·XH2O
I、硫酸铜晶体的制备
方案1:毛毛同学根据已学知识,提出了制备硫酸铜方案:
方案2:方舟同学查阅资料归纳了一种工业制备硫酸铜的流程:
(1)上述方案1中加热搅拌的作用是 ,形成蓝色溶液的化学反应方程式是: 。
(2)方案2中,加入H2O2后要求温度控制在50℃到60℃是为了防止 。
(3)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(4)方案中“一系列操作”依次为:过滤、、冷却结晶、(填序号)。
A.蒸发浓缩 B.加水稀释 C.加水溶解 D.过滤
(5)溶液M、N都是CuSO4的 (选填“饱和”、“不饱和”或“不一定饱和”)溶液,向其中加入无水CuSO4,均会析出硫酸铜晶体,这是因为 。
⑹所得硫酸铜晶体需要洗涤后晾干,最合适的洗涤试剂是 。
A.冷蒸馏水 B. 95%的酒精 C.热蒸馏水
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定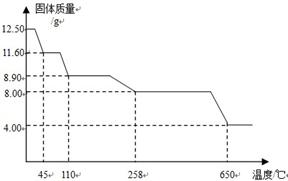
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行加热分解,获得相关数据,并绘制成固体质量一温度的关系图。
(7) 258℃时,固体完全变成白色粉末。根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程,3分)
(8)加热过程中,硫酸铜晶体分步失去结晶水。请写出45℃到110℃时反应方程式
(9) 580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省泰州市九年级下学期第二次涂卡训练化学试卷(解析版) 题型:简答题
某化学兴趣小组提出可以用含铜废料制备蓝色胆矾(CuSO4·XH2O)。
查阅资料:
Ⅰ 过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2)都会促进其分解。
Ⅱ CuSO4·XH2O易溶于水难溶于酒精,加热时会逐步失去结晶水,最终生成CuSO4。
Ⅲ 白色粉末CuSO4易与水化合生成CuSO4·XH2O
I、硫酸铜晶体的制备
方案1:毛毛同学根据已学知识,提出了制备硫酸铜方案:
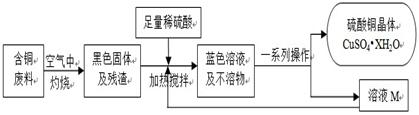
方案2:方舟同学查阅资料归纳了一种工业制备硫酸铜的流程:

(1)上述方案1中加热搅拌的作用是 ,形成蓝色溶液的化学反应方程式是: 。
(2)方案2中,加入H2O2后要求温度控制在50℃到60℃是为了防止 。
(3)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(4)方案中“一系列操作”依次为:过滤、、冷却结晶、(填序号)。
A.蒸发浓缩 B.加水稀释 C.加水溶解 D.过滤
(5)溶液M、N都是CuSO4的 (选填“饱和”、“不饱和”或“不一定饱和”)溶液,向其中加入无水CuSO4,均会析出硫酸铜晶体,这是因为 。
⑹所得硫酸铜晶体需要洗涤后晾干,最合适的洗涤试剂是 。
A.冷蒸馏水 B. 95%的酒精 C.热蒸馏水
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定
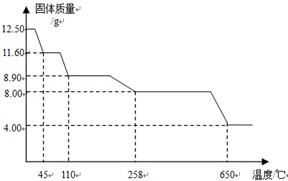
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行加热分解,获得相关数据,并绘制成固体质量一温度的关系图。
(7) 258℃时,固体完全变成白色粉末。根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程,3分)
(8)加热过程中,硫酸铜晶体分步失去结晶水。请写出45℃到110℃时反应方程式
(9) 580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com