
分析 【实验(1)】:在相同的条件下,碘难溶于水,易溶于汽油,溶质相同,而溶剂不同,溶解结果也不同,进而说明影响碘的溶解能力的因素是与溶剂有关,或者消失溶剂的性质或者是溶剂的种类都可以.
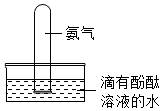
【实验(2)】:氨气(NH3)是一种有刺激性气味的气体,密度比空气小,极易溶于水,在实验室中通常用加热固体氯化铵和氢氧化钠的混合物来制取氨气.
①根据给出的反应物和反应条件以及部分生成物推断其他生成物,进而书写化学方程式;
②根据提示的氨气的性质选择合适的收集方式;
③氨气极易溶解于水且水溶液显碱性,进而分析;
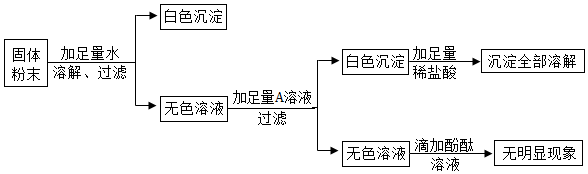
【实验(3)】:根据对应的现象分析混合物的组成;
【实验并计算(4)】:氢氧化钠溶液的质量增加就是二氧化碳的所致,所以可得二氧化碳的质量,进而根据二氧化碳的质量和对应的化学方程式求算参加反应的氧化铁的质量,然后求矿石中氧化铁的质量分数.
解答 解:
【实验(1)】:在相同的条件下,碘难溶于水,易溶于汽油,由于溶质相同,而溶剂不同,说明影响碘的溶解能力的因素是溶剂的性质或溶剂的种类.
【实验(2)】:
①实验室制取氨气的化学方程式为 2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.
②由于“氨气(NH3)是一种有刺激性气味的气体,密度比空气小,极易溶于水”,所以不能用排水法收集氨气,而只能用向下排空气法收集氨气.
③由于氨气极易溶于水,且溶液显碱性,所以将一个盛满干燥氨气的试管放入到滴有酚酞溶液的水中时,会观察到管内液面上升(极易溶解于水所致),溶液变成红色(氨水显碱性所致).
【实验(3)】
①上述实验中,过滤操作用到的仪器有铁架台、烧杯、玻璃棒以及漏斗和胶头滴管,其中属于玻璃仪器有:烧杯、玻璃棒以及漏斗和胶头滴管(胶头滴管一般可以不填).
②A物质的作用是用来检验碳酸钠和硫酸钠的,为可溶性钡盐或者钡碱,而由于后面要检测溶液酸碱性判断氢氧化钠的存在,所以不能使用碱性物质,因此不能使用钡碱,所以其化学式为 BaCl2或Ba(NO3)2.
③由于加水得到无色溶液和白色沉淀,所以可以判定混合物中无氯化铁而有碳酸钙.加入足量的可溶性钡盐得到白色沉淀,而该沉淀部分溶解于足量的硝酸,说明混合物中含有硫酸钠和碳酸钠.向无色溶液加入酚酞,无明显现象,说明原物质不含氢氧化钠,故该固体粉末中一定含有的物质是 CaCO3、Na2SO4、Na2CO3.
【实验并计算(4】
解:氢氧化钠溶液增重6.6g,说明生成了6.6g的二氧化碳
设赤铁矿石中氧化铁的质量为x
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 3×44
x 6.6g
160:132=x:6.6g
x=8g
样品中氧化铁的质量分数为:$\frac{8g}{10g}$×100%=80% 答:该样品中氧化铁的质量分数为80%.
故答案为:
(1)溶剂的性质(或溶剂的种类);
(2)
①2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
②向下排空气法;
③试管内液面上升,溶液变成红色.
(3)
①漏斗;
②BaCl2或Ba(NO3)2;
③CaCO3、Na2SO4、Na2CO3;
(4)解:设赤铁矿石中氧化铁的质量为x
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 3×44
x 6.6g
160:132=x:6.6g
x=8g
样品中氧化铁的质量分数为:$\frac{8g}{10g}$×100%=80% 答:该样品中氧化铁的质量分数为80%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH HNO3 BaCl2 MgSO4 | |
| B. | CuCl2 BaCl2 Na2SO4 NaNO3 | |
| C. | BaCl2 FeCl2 Na2SO4 H2SO4 | |
| D. | K2SO4 NaCl Na2CO3 HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com