
分析 碳酸钙和稀硫酸反应生成硫酸钙、水和二氧化碳,生成的硫酸钙微溶于水,包裹在碳酸钙的表面,阻止反应的进行;
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据提供的数据可以进行相关方面的计算.
解答 解:(1)因为稀硫酸和碳酸钙反应生成的硫酸钙微溶于水,阻止反应的进行,所以不能用稀硫酸代替盐酸.
故填:稀硫酸和碳酸钙反应生成的硫酸钙微溶于水,阻止反应的进行.
(2)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 44
x $\frac{73}{100}$x $\frac{44}{100}$x
根据题意有:x+($\frac{73}{100}$x÷10%)-$\frac{44}{100}$x=78.6g,
x=10g,
石灰石中碳酸钙的质量分数为:$\frac{10g}{15g}$×100%=66.7%,
答:石灰石中碳酸钙的质量分数为66.7%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


科目:初中化学 来源: 题型:解答题
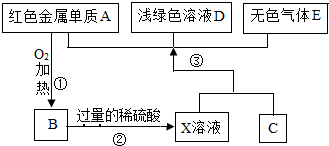 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 | 化学方程式 | |
| (1) | 取少量溶液于试管中,滴加无色酚酞溶液 | 无色酚酞变红 | 溶液显碱性 | |
| (2) | 取少量溶液于试管中,滴加稀盐酸 | 有气泡产生 | 溶液中存在碳酸根离子(或碳酸钠) | Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该反应中,X前的化学计量系数为10 | |
| B. | X中所含元素的质量比为1:16 | |
| C. | 反应前后所有元素的化合价都变化了 | |
| D. | 该实验发生装置与实验室用高锰酸钾制氧气的发生装置相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com