
 甲,乙,丙三种固体的溶解度曲线如图所示.据图回答:
甲,乙,丙三种固体的溶解度曲线如图所示.据图回答: ×100%并结合该温度下物质的溶解度分析解答;
×100%并结合该温度下物质的溶解度分析解答;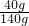 ×100%≈28.6%;
×100%≈28.6%;

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
 12、甲、乙、丙三种固体的溶解度曲线如图.将t1℃时甲、丙饱和溶液的试管(均有少量未溶解的固体)放进盛有热水(t2℃)的烧杯里.下列有关说法正确的是( )
12、甲、乙、丙三种固体的溶解度曲线如图.将t1℃时甲、丙饱和溶液的试管(均有少量未溶解的固体)放进盛有热水(t2℃)的烧杯里.下列有关说法正确的是( )查看答案和解析>>
科目:初中化学 来源: 题型:
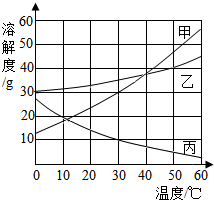 甲、乙、丙三种固体的溶解度曲线如图所示.据图回答:
甲、乙、丙三种固体的溶解度曲线如图所示.据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:
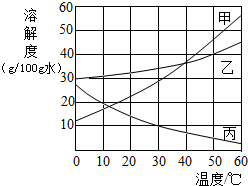 (2012?松江区二模)甲、乙、丙三种固体的溶解度曲线如图所示.据图回答:
(2012?松江区二模)甲、乙、丙三种固体的溶解度曲线如图所示.据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:
 甲,乙,丙三种固体的溶解度曲线如图所示.据图回答:
甲,乙,丙三种固体的溶解度曲线如图所示.据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com