
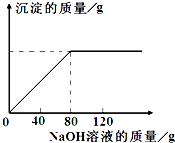
 从海水中提出的食盐中主要含有氯化钠,还有少量的氯化镁杂质.现取仅含氯化镁杂质的氯化钠样品30.0g,完全溶解于95.8g水后,再加入质量分数为10%的氢氧化钠溶液.反应过程中生成沉淀的质量与氢氧化钠溶液的质量关系如图所示(反应为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl).求:
从海水中提出的食盐中主要含有氯化钠,还有少量的氯化镁杂质.现取仅含氯化镁杂质的氯化钠样品30.0g,完全溶解于95.8g水后,再加入质量分数为10%的氢氧化钠溶液.反应过程中生成沉淀的质量与氢氧化钠溶液的质量关系如图所示(反应为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl).求:| 80 |
| 80g×10% |
| 58 |
| y |
| 117 |
| x |
| 95 |
| z |
| 32.2g |
| 200g |


科目:初中化学 来源: 题型:阅读理解
| 煅烧 |
| 加水 |
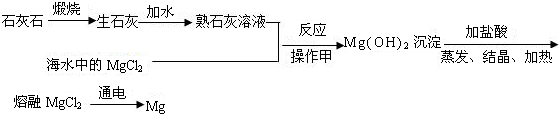
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |

查看答案和解析>>
科目:初中化学 来源:2006-2007学年度三甲中学九年中考模拟化学试卷(2) 题型:038
从海水中提出的食盐中主要含有氯化钠,还有少量的氯化镁杂质.现取仅含氯化镁杂质的氯化钠样品30.0 g,完全溶解于95.8 g水后,再加入质量分数为10%的氢氧化钠溶液.反应过程中生成沉淀的质量与氢氧化钠溶液的质量关系如图所示.求:
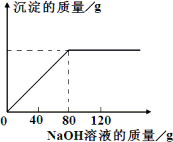
(1)恰好完全反应时消耗的NaOH溶液的质量为________g.
(2)恰好完全反应时所得溶液中溶质的质量分数
查看答案和解析>>
科目:初中化学 来源:2005-2006学年广东省九年级(上)第三次月考化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com