
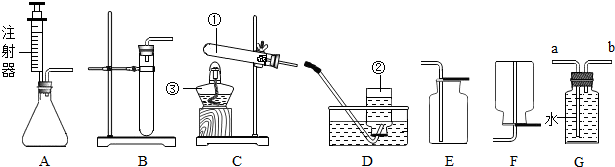
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,氧气密度比空气大,不易溶于水,所以可以采用排水法和向上排空气法收集进行分析;
(3)根据实验室制取氧气的正确步骤进行分析;
(4)根据注射器可以控制液体的滴加速度,二氧化锰是过氧化氢分解的催化剂进行分析;
(5)根据实验室制取乙炔的反应物是固体和液体,反应条件是常温,该反应必须严格控制加水的速度,氧气不易溶于水进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,①是试管,②是集气瓶;
(2)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,文字表达式为:高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气,氧气密度比空气大,不易溶于水,所以可以采用排水法和向上排空气法收集;
(3)实验室制取氧气时,先组装仪器,然后检验装置气密性,装药,加热,收集气体,实验结束先撤导管,然后熄灭酒精灯,所以正确的操作顺序为②①④③⑥⑤,故选:D;
(4)注射器可以控制液体的滴加速度,二氧化锰是过氧化氢分解的催化剂,所以A装置与B装置比较的优点是便于可知反应的速率,双氧水制氧气需要加入二氧化锰,二氧化锰在反应中发挥催化作用;
(5)实验室制取乙炔的反应物是固体和液体,反应条件是常温,该反应必须严格控制加水的速度,氧气不易溶于水,所以最适合制取乙炔气体的发生装置是A,如果用如图G收集乙炔气体,气体应从b进入.
故答案为:(1)试管,集气瓶;
(2)高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气,D,不易溶于水,E,氧气密度比空气大;
(3)D;
(4)便于可知反应的速率,催化;
(5)A,b.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


科目:初中化学 来源: 题型:选择题
 我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破.该转化的微观示意图如图所示.下列说法正确的是( )
我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破.该转化的微观示意图如图所示.下列说法正确的是( )| A. | 生成物之一为H2O | B. | 该反应属于分解反应 | ||
| C. | 反应后催化剂质量增加 | D. | 反应物与生成物共有4种分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | -1 | B. | +1 | C. | +3 | D. | +5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A对鉴别方法的认识 | B对安全的认识 |
| ①区分硬水和软水,加肥皂水后搅拌 ②区分棉纤维和羊毛纤维,点燃后闻气味 ③区分硫酸铵和硫酸钾,加熟石灰粉末研磨 | ①点燃可燃性气体前一定要验纯 ②煤矿矿井要保持通风、严禁烟火 ③海鲜食品喷洒甲醛溶液防腐 |
| C对现象的认识 | D对防锈的认识 |
| ①气体压缩,气体分子之间的间隔变小 ②活性炭除去异味,活性炭具有吸附性 ③喝汽水打嗝,气体溶解度随温度升高而增大 | ①自行车的支架喷油漆防锈 ②菜刀用后及时洗净擦干 ③保留铁锈可防止铁进一步锈蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
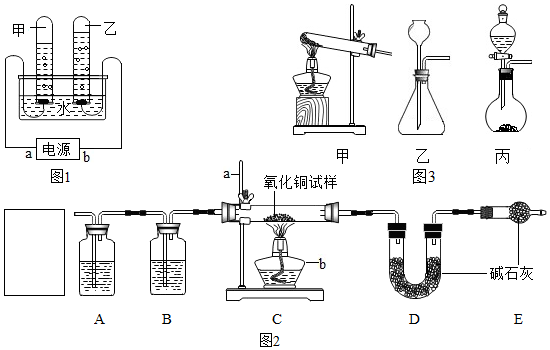
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
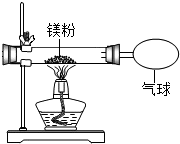 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 实验操作 | 实验现象 | 结论 |
| 取燃烧后的产物于试管中,加少量水,再将湿润的红色石蕊试纸放在试管口,观察现象. | 试管中有气体产生,湿润的红色石蕊试纸变蓝 | 燃烧产物中含有Mg3N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com