
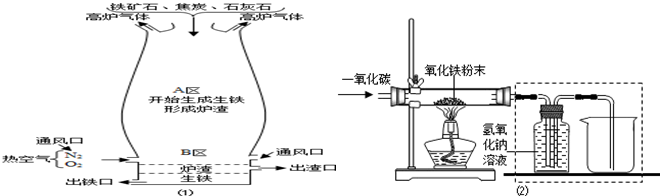
| ||
| ||
| ||
| ||
| ||
| ||
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
| ||
| ||
| ||
| 16×3 |
| 56×2+16×3 |
| ||
| 480 |
| 464 |
| 6g |
| x |
| ||
| ||
| ||


科目:初中化学 来源: 题型:
序数 质量 |
实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||

| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
查看答案和解析>>
科目:初中化学 来源:湛江 题型:问答题
序数 质量 |
实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
查看答案和解析>>
科目:初中化学 来源: 题型:
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com