
【题目】控制变量设计对比实验是实验探究的重要方法,请参与下列探究并回答问题:
实验一:探究影响过氧化氢溶液分解速率的因素

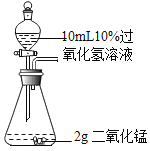
A B
同时打开A和B装置中分液漏斗的旋塞,根据锥形瓶内产生气泡的速率,得出_________会影响过氧化氢溶液的分解速率,为准确直观比较分解速率的快慢,可测定相同时间内收集到的氧气体积,或者测定_________。
实验二:探究金属与盐溶液的反应
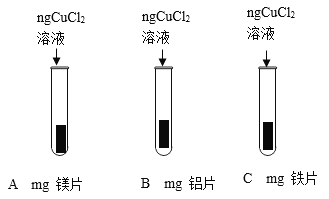
将打磨过的镁片、铝片、铁片分别与氯化铜溶液反应,观察到金属表面都有红色物质生成且镁片、铝片表面还有气泡产生,且产生气泡的速率镁比铝快,铁片表面几乎看不到气泡产生经查阅资料知氯化铜溶液呈酸性。请写出B试管内发生反应的化学方程式__________________;由此实验______________(填能或否)得出镁铝铁铜四种金属的活动性顺序。
实验三:探究二氧化碳能否与碱溶液反应
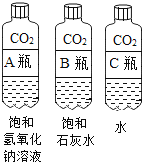
①对比 A 瓶与 B 瓶的实验现象,请说明实验室用氢氧化钠溶液吸收CO2,用石灰水检验二氧化碳的理由_________;
②A瓶与 B瓶的对比,因为 A瓶严重变瘪,说明_________消失,可证明二氧化碳与氢氧化钠溶液发生了反应,也可以通过加入下列物质中的_________证明新物质的生成,从而说明反应的发生。
A 酚酞试液 B 稀盐酸 C Ca(OH)2溶液 D CaCl2溶液
【答案】过氧化氢溶液的浓度 收集到相同体积气体所需的时间 2Al+3CuCl2=2AlCl3+3Cu;2Al+6HCl=2AlCl3+3H2↑ 能 氢氧化钠易溶于水,氢氧化钙微溶于水,使用氢氧化钠溶液吸收二氧化碳,更充分更彻底;二氧化碳与氢氧化钠溶液反应无明显现象,与氢氧化钙溶液反应,产生白色沉淀,使用氢氧化钙溶液检验二氧化碳,现象明显,更易判断 二氧化碳气体 BCD
【解析】
实验一:由题目的信息可知,同时打开A和B装置中分液漏斗的旋塞,观察锥形瓶中反应情况,装置B中的气泡比A多,过氧化氢溶液的浓度会影响过氧化氢的分解速率;测定相同时间内收集到的氧气体积,或者测定收集到相同体积气体所需的时间都可准确直观比较分解速率的快慢。故填:过氧化氢溶液的浓度;收集到相同体积气体所需的时间。
实验二:铝的活泼性比铜强,所以铝可以和氯化铜反应生成铜和氯化铝,反应的方程式为:2Al+3CuCl2=2AlCl3+3Cu;又因氯化铜溶液呈酸性,且观察到铝片表面还有气泡产生,所以铝还和里面的盐酸反应生成了氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑;A、B、C中均有红色物质生成,说明镁、铝、铁都能和氯化铜发生反应将铜置换出来,即镁、铝、铁的活泼性都强于铜,又因镁片、铝片表面还有气泡产生,且产生气泡的速率镁比铝快,铁片表面几乎看不到气泡,证明镁的活泼性强于铝,铝的活泼性强于铁,所以此实验能证明出来镁铝铁铜四种金属的活动性顺序。故填:2Al+3CuCl2=2AlCl3+3Cu、2Al+6HCl=2AlCl3+3H2↑;能。
实验三:①A瓶中瓶子变瘪的程度最大,B瓶中变瘪的程度比A小,且里面溶液变浑浊,是因为二氧化碳与石灰水反应产生白色沉淀,而二氧化碳与氢氧化钠反应没有明显的现象,因此检验二氧化碳选择石灰水;氢氧化钠易溶于水,而氢氧化钙微溶于水,因此等量的氢氧化钠溶液吸收二氧化碳比石灰水多,因此吸收二氧化碳选择氢氧化钠溶液;故填:氢氧化钠易溶于水,氢氧化钙微溶于水,使用氢氧化钠溶液吸收二氧化碳,更充分更彻底;二氧化碳与氢氧化钠溶液反应无明显现象,与氢氧化钙溶液反应,产生白色沉淀,使用氢氧化钙溶液检验二氧化碳,现象明显,更易判断。
②A瓶比B瓶变瘪严重是因为二氧化碳气体被氢氧化钠反应的多导致二氧化碳消失的多瓶内气压变小,所以瓶子会严重变瘪;二氧化碳和氢氧化钠反应生成碳酸钠和水,若加入酚酞进行检验不管氢氧化钠和二氧化碳反没反应都是会变红色,所以无法检验是否发生反应;若加入盐酸,盐酸会和碳酸钠反应有气泡生成,而和氢氧化钠反应无明显现象,这时只要有气泡生成就能证明氢氧化钠和二氧化碳反生了反应;若加入氢氧化钙,氢氧化钙会和碳酸钠反应生成白色沉淀,而不和氢氧化钠反应,这时只要有白色沉淀生成就能证明氢氧化钠和二氧化碳反生了反应;若加入氯化钙,氯化钙会和碳酸钠反应生成白色沉淀,而不和氢氧化钠反应,这时只要有白色沉淀生成就能证明氢氧化钠和二氧化碳反生了反应;故填:二氧化碳气体;BCD。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】南海钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物以略去):
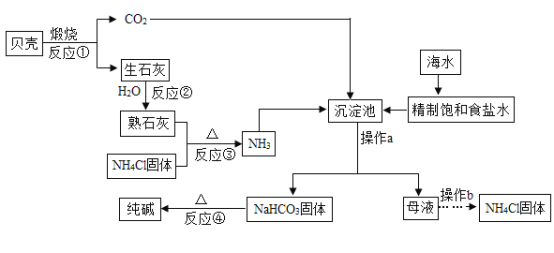
回答下列问题:
(1)操作a的名称是____, 在该操作中常使用烧杯、玻璃棒和_______这三种玻璃仪。
(2)“侯氏制碱法”的主要产品“碱"是指_____ (填化学式)。
(3)在沉淀池中发生的反应是:将NH3、CO2、饱和氯化钠溶液反应,生成NaHCO3固体和NH4Cl溶液,请写出该反应的化学方程式____________________________。
(4)仔细观察流程图,其中可循坏利用的物质除二氧化碳之外,逐有_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为三种物质的溶解度曲线。下列说法错误的是
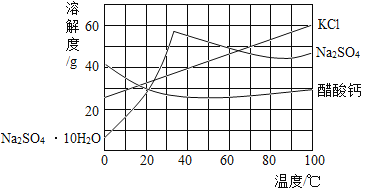
A.约在64℃时KCl和Na2SO4的溶解度相等
B.在室温至100℃区间,随温度升高,Na2SO4的溶解度先增大后减小,醋酸钙则相反
C.分离含少量KCl的Na2SO4溶液,采用先蒸发浓缩,后降温结晶的方法
D.在40℃时,40gKCl固体溶于60g水得到40%KCl溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国的北斗导航卫星系统采用铷原子钟,提供精确时间。如图是铷元素在元素周期表中的相关信息,下列说法正确的是
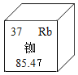
A. 铷元素属于非金属元素B. 铷元素的相对原子质量为85.47g
C. 铷原子的质子数等于中子数D. 铷元素的原子序数为37
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行氧气的制取和性质实验
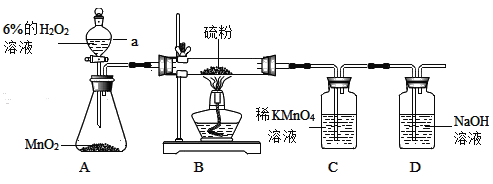
(1)装置A发生反应的化学方程方式___________;
(2)实验中,点燃酒精灯后,可观察到硫粉在氧气中燃烧呈现___________色火焰;装置C中的现象是___________;
(3)装置D的作用是____________(用化学方程式表示);
(4)为了证明装置C中出现的现象不是由氧气造成的,在不改变装置的情况下,操作方法是___________,并观察装置C中的现象
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学就在我们身边,请用所学的化学知识填空。
(1)从H、O、C、Cl、Ca五种元素中,选择适当的元素组成符合下列要求的物质,并用化学式填空(每空只填一种物质)。
①相对分子质量最小的氧化物是_______;
②农业上用来降低土壤酸性的_________;
③可用于金属表面除锈的是____________;
④厨房用的酸性调味品是____________;
⑤最简单的有机物是________。
(2)以下是日常生活中常用各种清洗剂
名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 活氧彩漂 | 污渍爆炸盐 |
产品样式 |
|
|
|
|
|
有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过氧化氢 | 过碳酸钠 |
①使用洗涤灵清洗餐具上的油污,这是因为它具有__________功能。
②清除以下物质,可使用炉具清洁剂的是______________(填字母序号)。
a.铁锈 b.油污 c.水垢
③“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,此反应体现了如图中______________(选填①②③④)性质关系。

④将洁厕灵加入滴有酚酞的炉具清洁剂中,若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向各装有50g水的A、B、C烧杯中分别加入30g、48g、48gNaNO3固体,充分溶解后,现象如图所示。
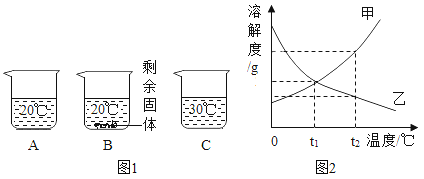
(1)烧杯中的溶液一定属于饱和溶液的是___________(填字母)。
(2)烧杯C中溶质的质量分数为___________。
(3)图2能表示NaNO3溶解度曲线的是____________(填“甲”或“乙”)。
(4)由图2分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,下列对所得溶液的叙述正确的是__________(填字母)。
A甲、乙都是饱和溶液 B所含溶剂质量:甲=乙
C溶液质量:甲>乙 D溶质质量分数:甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下图所示装置研究氧气的性质,并测定空气中氧气的含量。
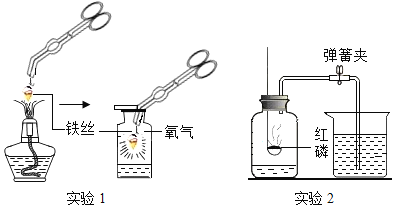
(1)实验 1 中铁丝发生了化学反应,证据是________________。该反应的化学方程式为__________________________。
(2)实验 2 中,点燃红磷前需要用弹簧夹夹紧胶皮管的原因是____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水与人类的生活和生产密切相关,请回答下列问题:
(1)电解水实验揭示了水的组成。如图1实验中得到氧气的试管是_____(填“1”或“2”)
(2)自来水厂净水过程中用到活性炭,其作用是_____。
(3)海水淡化可缓解淡水资源匮乏的问题,如图2为太阳能海水淡化装置示意图。
①水变成水蒸气的过程中,不发生变化的是_____(填字母序号)
A 分子质量 B 分子种类 C 分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会_____(填“变大”、“变小”或“不变”)
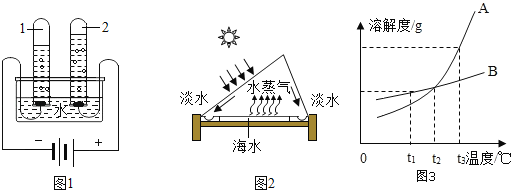
(4)如图3是A、B两种物质的溶解度曲线,根据图示回答问题:
①t1℃时,A、B两种物质的溶解度是A_____B(填“>”、“<”或“=”,下同)。
②将t3℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A_____B。
(3)t2℃时,100g水中溶解50gA刚好饱和,那么50g水中溶解_____gB也刚好达饱和,此时溶液的质量分数是_____(精确到0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com