
【题目】请根据题目要求回答下列问题。
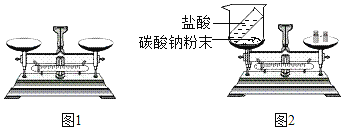
(1)图1为托盘天平,使用托盘天平称物品的正确操作顺序为_____。
①调游码 ②放称量纸 ③称量物放左盘④调零点 ⑤加质量大的砝码 ⑥加质量小的砝码
A.①②③④⑤⑥ B.④②③⑤⑥① C.④⑤⑥①②③ D.④①②③⑤⑥
(2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,发生反应的实验现象为_____,发生反应的化学方程式为_____,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m2,则(填“=”“>”“<”,)m1_____m2。
(3)图2装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=”“>”“<”,1分)m1_____m2,其原因为_____。
【答案】 B 铁钉表面有红色物质生成,溶液由蓝色逐渐变为浅绿色 Fe+CuSO4=Cu+FeSO4 m1=m2 m1 > m2 生成的二氧化碳扩散到空气中
【解析】参加反应的各物质的质量总和等于反应后生成各物质的质量总和。这个规律就叫做质量守恒定律。(1)使用托盘天平称物品的正确操作顺序为④调零点,②放称量纸,③称量物放左盘,⑤加质量大的砝码,⑥加质量小的砝码,①调游码。(2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,发生反应的实验现象为铁钉表面有红色物质生成,溶液由蓝色逐渐变为浅绿色,发生反应的化学方程式为Fe+CuSO4=Cu+FeSO4,硫酸铜溶液呈蓝色,硫酸亚铁溶液呈浅绿色,金属铜为红色。再称量小烧杯及烧杯内物质的总质量为 m2,根据质量守恒定律,则m1=m2。(3)小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧瓶内物质的总质量为m1>m2,其原因为生成的二氧化碳扩散到空气中。
点睛∶质量守恒定律应注意⑴化学变化⑵质量定恒⑶参加反应和反应后生成,这是理解质量守恒定律的关键,反应物的质量总和不包括反应物过量的部分。生成物的质量总和是指反应后新生成的,不包括原先就存在的。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:初中化学 来源: 题型:
【题目】如下图是实验室配制一定溶质质量分数的KNO3溶液的流程图。请回答:
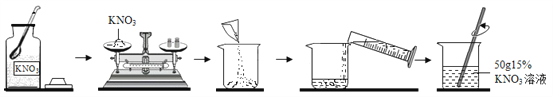
(1)计算:用托盘天平应称量_____________g KNO3。
(2)称量:若称量KNO3固体时指针向左偏转,则应________(填字母),直到天平平衡。
A.增加砝码 B.移动游码 C.减少KNO3固体 D.增加KNO3固体
(3)量取:量取水时,应选择___________(填“10mL”、“50mL”或“100mL”)的量筒。
(4)溶解:若KNO3已结块,为了较快地溶解,合理的方法有__________(填数字序号)。
①将硝酸钾研碎 ②用热水溶解 ③加入更多的水 ④用玻璃棒搅拌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如图。某学习小组对加入0—— VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究:

【猜想假设】
猜想Ⅰ:pH增大是因为 ;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式 。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7。
(2)向2mL0.4%的盐酸中加入VmL ,用pH计测得混合液的pH 7(填“>”、“=”或“<”)。综合(1)和(2)证明猜想Ⅱ成立。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学反应微观示意图(不同的小球代表不同的原子),下列对此变化的描述中不正确的是( )
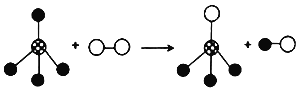
A. 该化学反应前后分子种类不变 B. 该化学反应前后原子种类不变
C. 该化学反应前后分子总数不变 D. 该化学反应前后质量总和不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E是初中化学中常见的化合物.其中A、D、E都含有钙元素,B、C、D是氧化物,且常温下B是气体、C是液体、D是固体.结合下列图示信息.回答下列问题:
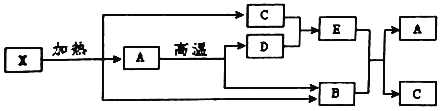
(1)根据图示信息可知物质X是由_____元素组成的.
(2)写出D物质的一种用途_____.
(3)写出下列转化的化学方程式:①A![]() B+D:_____;②C+D→E:_____.
B+D:_____;②C+D→E:_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图是某学生2011年1月6日购买的口香糖的标签,请回答下列问题:

(1)这种口香糖存在的问题是什么。
(2)口香糖可保护牙齿,活动面部肌肉,但也含造成环境问题,仔细观察标签,请回答吃完后剩余胶基的正确处理方法。
(3)食品中加入抗氧化剂可防止食品腐败,BHT(化学式C13H30O)是一种抗氧化剂,该物质的相对分子质量,C、H、O的原子个数比,碳元素的质量分数(精确至0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组的同学用锌粒与如图1中的硫酸溶液(部分标签被腐蚀)反应时,发现有气泡产生,并闻到有刺激性气味,他们对此气体的成分进行了探究。
【提出问题】锌粒加入硫酸溶液反应生成的气体是什么?
【查阅资料】
①浓硫酸也可以与锌粒发生反应,但不会生成氢气,也不会生成氧气,能生成二氧化硫气体。
②二氧化硫有刺激性气味,易溶于水,能使品红(一种红色素)溶液褪色。
③浓硫酸有吸水性,常用作干燥剂
④氢氧化钠溶液可吸收二氧化硫,并生成亚硫酸钠(Na2SO3)和水
【提出猜想】
甲同学认为:气体可能是H2;
乙同学认为:气体可能是SO2;
丙同学认为:气体还可能是_____。
【实验探究】为了验证上述猜想,同学们在老师的指导下设计了如图2的装置(部分夹持器材略去,假设每个能发生的反应都能完全进行)进行探究:

(1)图中a仪器的名称是_____,D处气体发生装置,可选图中的_____(填字母序号)
(2)实验开始后,观察到E中品红溶液褪色,证明气体中含有_____。
(3)H装置的作用是_____,写出发生反应的化学方程式_____。
(4)G装置加热一段时间后,观察到的现象是_____,证明气体中含有氢气。
【实验结论】_____同学的猜想是正确的。
【反思与交流】
(5)锌与浓硫酸反应生成硫酸锌、水和二氧化硫,为何反应过程中又产生氢气了呢?用文字简述原因_____。
(6)锌与浓硫酸、稀硫酸反应都可以生成硫酸锌,如果需要制取硫酸锌,往往选用锌与稀硫酸反应,其优点是_____(答案合理即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)将相同规格光亮的铁丝同时放入下列装置中进行实验,试回答下列问题: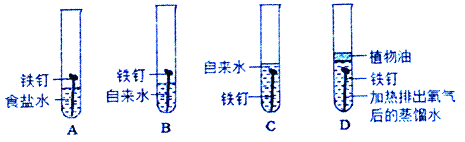
①一段时间后,铁钉一定无明显变化的_____(填字母,下同).
②大约一周时间后,将铁钉取出烘干,其质量由小到大的顺序为_____
③通过该实验可以得出铁制品锈蚀的条件为:_____
(2)为探究稀硫酸与氢氧化钠溶液的反应,设计下列实验方案:将稀硫酸溶液逐滴滴入含有无色酚酞的氢氧化钠溶液中,并用玻璃棒不断搅拌,PH值变化曲线如下图所示.
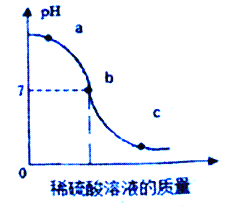
①实验过程中观察到的现象是:_____
②写出该反应的化学方程式:_____
③图中c 点溶液中的溶质是_____(写化学式)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】地壳中的元素含量如图所示。回答下列问题:
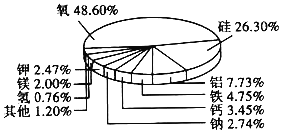
(1)含量居第一位的金属元素,其元素符号是_____。
(2)含量居第二位的元素,其原子结构示意图是_____;该元素位于元素周期表中第_____ 周期。
(3)用离子符号表示由氢、氧原子构成的常见原子团_____。
(4)由氢、氧、镁三种元素组成的化合物的化学式为_____,该物质的名称读成_____。
(5)含量居第二位的金属元素组成的单质在氧气中燃烧的反应方程式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com