
科目:初中化学 来源: 题型:
| 化 学 反 应 | 化学反应方程式 | 简 答 | ||||||||
| 实验室制取氧气 | 2KMnO4
2KMnO4
|
反应类型 分解反应 分解反应 | ||||||||
| 暴露在空气中的澄清石灰水,会产生浑浊 | CO2+Ca(OH)2═CaCO3↓+H2O CO2+Ca(OH)2═CaCO3↓+H2O |
|||||||||
| 硫在氧气中燃烧 | S+O2
S+O2
|
火焰颜色为 蓝紫 蓝紫 色 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
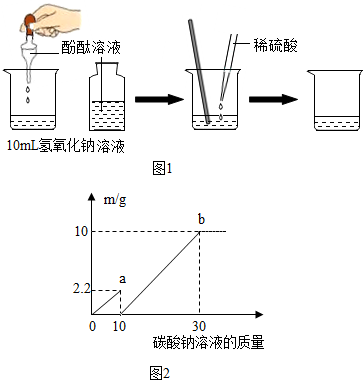 (2012?南京二模)小徐和老师共同完成以下两个实验探究.
(2012?南京二模)小徐和老师共同完成以下两个实验探究.| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞溶液; ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液. |
①溶液颜色 变红色 变红色 ;②不断搅拌溶液至溶液颜色恰好变成 无 无 色为止. |
酸和碱发生了中和反应,该反应属四种基本反应类型中 复分解 复分解 的反应. |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好反应 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:
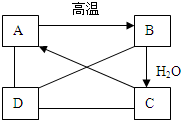 (2010?菏泽)A、B、C、D四种物质,如图所示,A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀盐酸的白色沉淀.
(2010?菏泽)A、B、C、D四种物质,如图所示,A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀盐酸的白色沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:
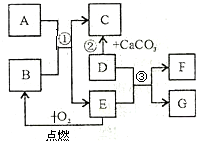 初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题:
初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题:
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com