4.安多夫是一种嫩肉粉,其主要成分碳酸氢钠(NaHCO
3)和氯化钠.安多夫可破坏肉质纤维结构、促进肉类吸收水分,从而使肉质松软,达到鲜嫩爽滑的目的.小张发现将拌了安多夫粉的肉类放到锅中加入食醋等调料烧煮时会产生大量的气体,他对此颇感兴趣,决定对其进行探究.
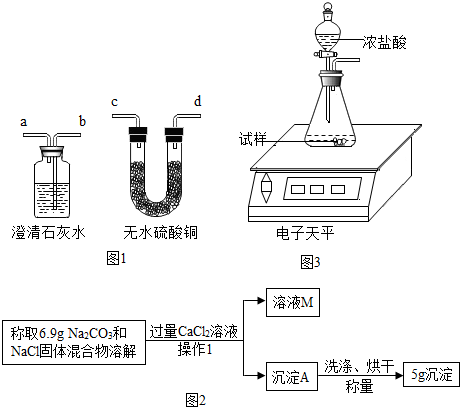
【查阅资料】
1.碳酸氢钠俗称“小苏打”、“苏打粉”、“重曹”,白色细小晶体,加热到50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解.
2.白色无水硫酸铜遇到水会变成蓝色.
【实验探究一】对烧煮时产生的确大量气体的探究
1.小于对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO
2.他设法收集气体样品并除去醋酸气体后,用右图1实验装置进行验证.装置导
气口连接顺序:气体样品→c→d→b→a
2.小于对二氧化碳的来源作了两种猜测:
猜测①:二氧化碳可能是由醋酸和碳酸氢钠反应产生的;
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的.
针对以上猜测,小于设计了以下实验:
| 实验步骤 | 实验现象 |
| 实验1 | 取安多夫样品少许加入试管中,加入醋酸,并把产生的气体通入澄清石灰水 | 产生气泡,澄清石灰水变浑浊 |
| 实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末. |
实验结论:猜想①、②都正确
(3)【实验探究二】测定安多夫样品中碳酸氢钠的含量
实验2中,小于发现充分反应后,试管中仍留有一些白色固体粉末,通过查阅资料发现是碳酸钠和氯化钠.小于想用测定白色固体中碳酸钠的质量来推算安多夫样品中碳酸氢钠的含量,于是称取实验2中得到的白色固体粉末6.9克,设计了如下实验方案:如图3
(1)写出“操作1”中任意一种玻璃仪器的名称烧杯,或漏斗,或玻璃棒,实验中加入过量CaCl
2溶液的目的是使碳酸钠完全反应.
(2)该安多夫样品中NaHCO
3的质量分数是多少?(写出解题过程)
(3)如果沉淀A未经洗涤和干燥会使最终测得NaHCO
3的质量分数偏大.
(4)小明同学看到这个设计实验后,提出一个更简单的测定方法,设计思路如下:
①电子天平调零
②检查装置气密性
③装入M克安多夫样品,浓盐酸
④称药品和装置的总质量W
1克
⑤滴入浓盐酸
⑥无气泡产生后,再称整个装置的质量W
2克
⑦(W
2-W
1)减轻的质量就是二氧化碳的质量
通过化学方程式计算NaHCO
3的质量,最终达到计算安多夫样品中NaHCO
3的质量分数的目的.
【方案评价】两位同学经过多次的实验测定后发现,得到的最终结果总是比真实值偏大,请你帮他们分析结果偏大的原因可能是BC.
A.所加酸的量不足
B.实验中使用了浓盐酸
C.未考虑反应过程中水的蒸发
D.未考虑生成的二氧化碳气体残留在装置内如图2.




