

分析 ①根据反应物的状态和反应条件均可选出氢气、氧气、二氧化碳的发生装置;
②二氧化碳的验满是用燃着的木条放在瓶口观看木条是否熄灭的方法;
③用高锰酸钾制取氧气时,试管口应放一团棉花,反应过程中氧原子的利用率可根据化学方程式中氧原子的个数求出,高锰酸钾完全分解后,要回收二氧化锰,可利用二氧化锰和锰酸钾的溶解性不同分离混合物;
④蒸发结晶时为防止液滴向四周飞溅,可用玻璃棒搅拌;
解答 解:
(1)用锌和稀硫酸制氢气应选择固液常温性发生装置,又氢气的密度比空气小且难溶于水,所以发生装置可选B或F,操作时相对比较方便,能随开随用可选用F;收集装置可选D或E,为收集到较纯净的氢气应选择排水法收集.故选F;D.
(3)实验室用石灰石和稀盐酸反应生成氯化钙、水和二氧化碳,但若用碳酸氢钠加热制取二氧化碳,化学反应方程式即为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,发生装置应选固体加热型.
故选CaCO3+2HCl=CaCl2+H2O+CO2↑;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;A;用燃着的木条放置于瓶口,木条熄灭.
(4)用高锰酸钾制氧气时,为防止高锰酸钾粉末进入导管,需在试管口放一团棉花,根据高锰酸钾分解的化学方程式可以看出参加反应的氧原子8个,生成物中氧气中氧原子数只有2个,所以氧原子的利用率为2÷8=25%.
故答案为:在试管口放一团膨松的棉花;25%(或1/4).
(5)高锰酸钾完全分解后剩余物中只有二氧化锰和锰酸钾,而二氧化锰不溶于水,锰酸钾溶于水,所以可以利用溶解过滤的方法得到二氧化锰,然后进行洗涤干燥即可,故选②③④①.
(6)蒸发时为防止液滴向四周飞溅,所以要用玻璃棒不停的搅拌,故答案为:搅拌使液体受热均匀,防止飞溅.
答案:
(1)FD
(2)BGC或FGC 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ A 用燃着的木条放置于瓶口,木条熄灭则已经满了.
(3)在试管口放一团膨松的棉花 25%(或1/4)
(4)②③④①
(5)搅拌使液体受热均匀,防止飞溅
点评 本题综合考查气体的实验室制法原理和装置选择,同时进行类比训练和知识延伸,与混合物的分离联系起来进行考查.


科目:初中化学 来源: 题型:解答题
 如图所示是镁带燃烧实验,回答下列问题:
如图所示是镁带燃烧实验,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 某些食品密封包装时充入氮气 | B. | 用较浓的食醋除水垢 | ||
| C. | 煤燃烧时向煤炉中不断地鼓入空气 | D. | 面团发酵时放在温热处 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
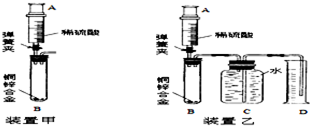 学习小组的同学在老师的帮助下对黄铜中铜和锌的含量展开探究.
学习小组的同学在老师的帮助下对黄铜中铜和锌的含量展开探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com