
醋酸钙[Ca(Ac)2]是国家允许使用的补钙制剂之一.以蛋壳为原料回收膜并制备醋酸钙的一种工艺流程如图.
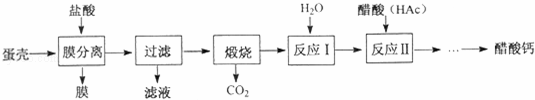
(1)写出煅烧时的化学方程式 .CO2的任意排放会引发的环境问题是 .CO2与CH4一定条件下化合可生成甲醛(HCHO),则此反应中CO2与CH4的最佳质量比是 .下列做法能减少二氧化碳排放的是 .(填序号)
a.焚烧秸杆 b.发展火力发电 c.发展太阳能
(2)在反应Ⅰ中制备石灰乳,而不是制备澄清石灰水的目的是 .写出熟石灰的一种用途 .
(3)在反应Ⅱ中醋酸过量的目的是 .写出反应Ⅱ的化学方程式 .
(4)膜分离时,盐酸不能过量的主要原因是 .
考点:
物质的相互转化和制备;二氧化碳对环境的影响;酸的化学性质;常见碱的特性和用途;书写化学方程式、文字表达式、电离方程式.
专题:
物质的制备.
分析:
(1)碳酸钙在高温条件下分解生成氧化钙和二氧化碳;
二氧化碳是一种主要的温室气体;
根据反应的化学方程式可以判断反应物之间的质量比;
(2)氢氧化钙的溶解度很小;
(3)氢氧化钙和醋酸反应生成醋酸钙和水;
(4)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳.
解答:
解:(1)煅烧碳酸钙时的化学方程式为:CaCO3 CaO+CO2↑;
CaO+CO2↑;
CO2的任意排放会引发的环境问题是温室效应;
CO2与CH4一定条件下化合可生成甲醛(HCHO),反应的化学方程式为:CO2+CH4═ 2HCHO,
2HCHO,
则此反应中CO2与CH4的最佳质量比为:44:16=11:4;
a.焚烧秸杆时能够产生大量的二氧化碳;
b.发展火力发电时需要燃烧大量的煤,煤燃烧时能够产生大量的二氧化碳;
c.发展太阳能不会产生二氧化碳.
故填:CaCO3 CaO+CO2↑;温室效应;11:4;c.
CaO+CO2↑;温室效应;11:4;c.
(2)在反应Ⅰ中制备石灰乳,而不是制备澄清石灰水的目的是石灰乳中氢氧化钙的含量高;
熟石灰的水溶液显碱性,可以用来改良酸性土壤.
故填:石灰乳中氢氧化钙的含量高;改良酸性土壤.
(3)在反应Ⅱ中醋酸过量的目的是使氢氧化钙完全反应;
反应Ⅱ的化学方程式为:Ca(OH)2+2HAc═Ca(Ac)2+2H2O.
故填:使氢氧化钙完全反应;Ca(OH)2+2HAc═Ca(Ac)2+2H2O.
(4)膜分离时,盐酸不能过量的主要原因是防止盐酸和碳酸钙反应.
故填:防止盐酸和碳酸钙反应.
点评:
合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:
下列选项中,除杂试剂或方法不正确的是( )
| 选项 | 物质 | 杂质 | 除杂试剂或方法 |
| A | KCl | MnO2 | 溶解、过滤、蒸 |
| B | NaCl | Na2CO3 | 加入适量稀硫酸、蒸发 |
| C | Cu | CuO | 加入足量稀盐酸、过滤 |
| D | CaO | CaCO3 | 高温煅烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:
下列三个实验均可证明CO2能与NaOH溶液反应。
实验Ⅰ:用试管集满CO2,迅速加入NaOH溶液、塞紧橡皮塞,充分振荡,静置。
(1)实验后打开橡皮塞时,听到响亮的“啵”声,其原因是实验后试管中的气压________(填“变大”或“变小”);
(2)对静置后的溶液进行下列操作,由对应的现象可推知CO2与NaOH溶液一定反应的是________(填序号)。
a. 滴加酚酞,溶液变为红色
b. 滴加少量稀盐酸,不产生气泡
c. 滴加少量氯化钡溶液,产生白色沉淀
实验Ⅱ:在8.0 g NaOH固体中加入适量95%的乙醇溶液,配制成饱和NaOH的乙醇溶液,向该溶液中通入CO2,直至产生白色沉淀Na2CO3。
(1)某托盘天平标尺的最大刻度为1 g,配备有1 g、2 g、5 g和10 g四种砝码若干个,用该天平称取8.0 g NaOH固体时,所需砝码总数为________个;
(2)实验Ⅱ利用的原理是:________影响物质的溶解性。
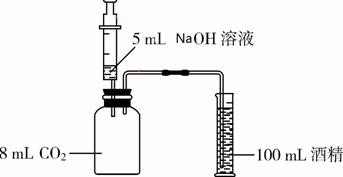
实验Ⅲ:如图5所示,将5 mL溶质质量分数为10%的NaOH溶液(ρ≈1.1 g/mL)缓慢、全部注射入瓶中,观察到酒精倒流入瓶中,最终瓶中剩余5 mL气体。此实验条件下,1体积水约可溶1体积CO2,CO2不溶于酒精,ρ(CO2)≈2 gL。
(1)实验时________(填“能”或“不能”)用水代替量筒中的酒精;
(2)实验时将NaOH溶液缓慢注射入瓶中的原因是________;
(3)根据上述实验可推知:与NaOH溶液反应的CO2约为________(取整数)mL;
(4)理论上,上述5 mL NaOH溶液与足量CO2反应都转化为Na2CO3时,参加反应的CO2的体积大约为多少毫升?(写出计算过程,结果取整数)
(5)实际上,上述NaOH溶液吸收的CO2偏少,其原因可能是________(填序号)。
a . CO2不纯 b. 装置漏气
. CO2不纯 b. 装置漏气
c. NaOH与CO2化合生成了NaHCO3
d. 倒流入瓶中的酒精干扰了NaOH溶液对CO2的吸收
查看答案和解析>>
科目:初中化学 来源: 题型:
小明设计了下列四组物质,要求在一定条件下都能一步转化,其中错误的是( )
|
| A. | Na2CO3→NaCl→NaNO3→NaOH | B. | C→CO→CO2→Na2CO3 |
|
| C. | Cu→CuO→CuSO4→Cu(OH)2 | D. | CaCO3→CaO→Ca(OH)2→NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:
下列各组物质间能通过一步反应就能实现如图转化的是( )
| X | Y | Z | |
| A | H2SO4 | H2 | H2O |
| B | CuSO4 | CuCl2 | Cu(OH)2 |
| C | H2O | H2 | CO2 |
| D | Ca(OH)2 | NaOH | Na2CO3 |

|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:
铜跟浓硫酸的反应原理是Cu+2H2SO4(浓)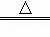 CuSO4+SO2↑+2H2O,某小组同学用如图所示装置制取硫酸铜,请回答下列问题.
CuSO4+SO2↑+2H2O,某小组同学用如图所示装置制取硫酸铜,请回答下列问题.
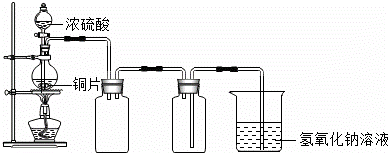
(1)图中B装置用来收集SO2(已知SO2的密度大于CO2的密度),但未将导管画全,请将B装置中的导管补画完整
(2)图中C装置的作用是放置氢氧化钠溶液倒吸入B瓶中,装置D的作用是 .
(3)充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤、用滤液做了如下实验.
实验1:用pH试纸测试滤液pH,其中pH约为1
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象.
你认为 可以说明明矾有剩余(选填“实验1”或“实验2”)
(4)以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有 (答出两点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
黄铜矿(主要万分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜.主要步骤如图所示:
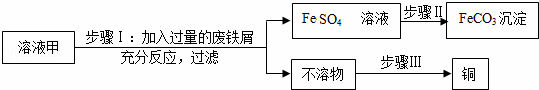
(1)Fe2(SO4)3与铁反应的化学方程式:xFe2(SO4)3+yFe=zFeSO4,其中x、y、z为化学计量数,z的值为 .
(2)步骤Ⅰ中,生成铜的化学方程式: .
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是 .
(4)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是 (填化学式).
(5)步骤Ⅲ回收铜的方法为 .
查看答案和解析>>
科目:初中化学 来源: 题型:
重铬酸钾(K2Cr2O7)可用于测定酒驾中的酒精(C2H5OH)含量。下列说法正确的是
A.K2Cr2O7中铬元素的化合价为+7 B.K2Cr2O7属于氧化物
C.C2H5OH的相对分子质量为46 D.C2H5OH中C、H、O的原子个数比为2:5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com