
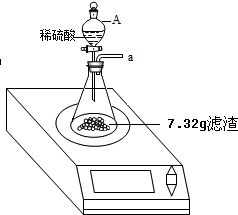
 某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.分析 (1)根据氯化钠能溶于水,铁粉、活性炭不易溶于水,可通过加水溶解掉氯化钠进行分析;
(2)样品在稀硫酸中除了Fe、Fe2O3分别能与稀硫酸反应外,还存在反应:Fe+Fe2(SO4)3=3FeSO4.因此,小明用产生H2的质量计算样品中铁的质量不合理;
(3)根据生成的氢气的质量为可求出与硫酸反应的铁的质量,可求出铁的质量.
解答 解:(1)将样品加足量水充分搅拌溶解,将样品中的氯化钠溶解掉了;故填:溶解样品中氯化钠;
(2)样品在稀硫酸中除了Fe、Fe2O3分别能与稀硫酸反应外,还存在反应:Fe+Fe2(SO4)3=3FeSO4.因此,小明用产生H2的质量计算样品中铁的质量不合理.实际上,样品中单质铁的质量应该是与酸反应消耗的铁和与Fe2(SO4)3反应消耗铁的质量总和.
故填:样品中的铁,除了与稀硫酸反应生成H2外,还有一部分铁与硫酸铁溶液反应;
(3)因为脱氧剂还没有失效.设生成0.1g氢气需要铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.1g
$\frac{56}{x}=\frac{2}{0.1g}$,
x=2.8g
即样品中铁的质量是2.8g.
由上述计算可知,铁与氧化铁的质量为:7.32g-1.82g-2.8g=2.7g.
设与硫酸铁反应的铁的质量为z
由于Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;Fe+Fe2(SO4)3=3FeSO4
可得:Fe~Fe2(SO4)3~Fe2O3
56 160
Z $\frac{160z}{56}$
所以:z+$\frac{160z}{56}$=2.7g 解得 z=0.7g
10g该样品中铁粉的质量为:2.8g+0.7g=3.5g
故答案为3.5g.
点评 解答本题的关键是要掌握铁的物理性质和化学性质两方面的知识及其化学方程式的书写方法并结合信息给与的数据,只有这样才能对问题做出正确的判断,难度较大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 样品质量(g) | 100 | 100 | 100 | 100 |
| 氢氧化钠溶液质量(g) | 40 | 80 | 120 | 160 |
| 沉淀质量(g) | 2.9 | 5.8 | 8.7 | 8.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加入稀盐酸的质量/g | 50 | 50 | 50 | 50 |
| 剩余固体的质量/g | 11 | 7 | 5 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质与氧气发生的反应都属于氧化反应 | |
| B. | 物质燃烧都需要氧气,所以有氧气参加的反应一定是燃烧 | |
| C. | 氧气具有助燃性,可以用作燃料 | |
| D. | 人在长跑时急促呼吸属于剧烈氧化 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气是一种化合物 | |
| B. | 空气是由多种单质组成的混合气体 | |
| C. | 空气中含量最多的是氧气 | |
| D. | 空气是由多种单质和化合物组成的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com