
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)“健康饮食、均衡营养”是青少年健康成长的重要保证。下列物质中富含蛋白质的有________(填字母)。
A 米饭和馒头 B 大豆油和花生油 C 牛肉和鸡蛋 D 蔬菜和水果
(2)“食品安全”是一个永恒的话题。你认为下列认识科学的是________(填字母)。
A 任何食品都不可以使用食品添加剂
B 霉变的大米、花生,即使经过蒸煮也不能食用
C 含钙、锌的奶粉有利于补充人体所需的常量元素
D 用工业用盐亚硝酸钠代替食盐来腌渍食品
(3)生活中可用__________鉴别硬水和软水。
(4)加入洗涤剂的水能除去衣服上的油污,是利用了洗涤剂的________作用。
(5)尿素是一种常用的化肥,工业上生产尿素反应的微观示意图如图:
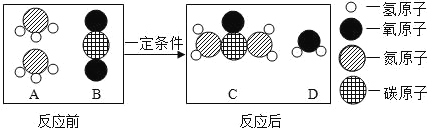
该反应中两种反应物A和B的质量比为_____________。
【答案】C B 肥皂水 乳化 17:22
【解析】
(1)牛肉和鸡蛋中富含大量蛋白质,故选:C。
(2)A 、任何食品都不可以使用食品添加剂太绝对,有些食品可以添加食品添加剂,A错。
B 、霉变的大米、花生含有黄曲霉素,即使经过蒸煮也不能食用,选项正确。
C 、锌属于微量元素,不属于常量元素,选项错误。
D 、用工业用盐亚硝酸钠有毒,不能代替食盐来腌渍食品,选项错误。
故选:C。
(3)生活中用肥皂水鉴别硬水和软水,硬水加入肥皂水浮渣多,起泡少。软水加入肥皂水,浮渣少起泡多,故填:肥皂水。
(4)加入洗涤剂的水能除去衣服上的油污,是利用了洗涤剂的乳化作用,故填:乳化。
(5)由微观示意图可知A为氨气B为二氧化碳,两个A分子反应了一个B分子,故质量比为:(1×3+14)×2:(12+16×2)==17:22


科目:初中化学 来源: 题型:
【题目】碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
【提出问题】 KI变质的条件是什么?
【查阅资料】
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
【进行实验】分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
【解释与结论】
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
【提出问题2】CO2的作用是什么?
【进行实验】分别取10 mL同浓度的KI溶液于3支试管中,再向试管2中通入CO2,向试管3中滴加几滴盐酸;分别测溶液的pH;几分钟后,观察溶液的颜色;再向试管中滴入淀粉溶液,观察溶液的颜色。实验现象记录如下:
试管序号 | 1 | 2 | 3 |
溶液pH | pH=8.5 | pH=6.5 | pH=4.5 |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
滴加淀粉溶液后的颜色 | 无色 | 紫色 | 深紫色 |
较长时间后,观察到试管1中溶液变为紫色。
【解释与结论】
(4)试管1实验的目的是_______。
(5)CO2在KI变质过程中的作用是_______。
【反思与评价】
(6)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钢铁的冶炼是人类文明的一个重要标志。下图1是实验室模拟炼铁的装置图。
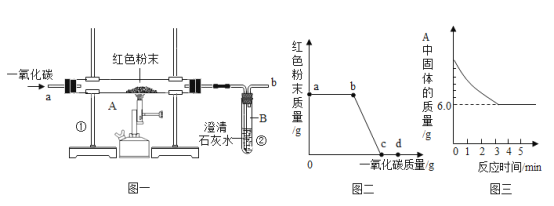
(1)写出图一中②处发生的化学反应方程式:___________________________________;
(2)实验过程中通入CO质量与红色粉末质量的关系如图2所示。根据图示,下列说法不正确的是_______(填序号)
①a 点表示开始通入CO,反应开始发生;
②b 点表示通入CO一段时间后加热,反应开始发生;
③c 点表示红色粉末已充分参加反应;
④d 点表示反应结束后仍需继续通入CO;
⑤可根据通入CO的质量计算出红色粉末的质量。
(3)图一装置中的不足之处是__________________________________;
(4)该实验炼制的铁与工业炼制出的铁最大的区别是________________________。
(5)某化学小组的同学们利用上述实验对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们取了固体样品质量7.2 g,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用如图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:碳酸氢铵受热易分解,反应的化学方程式为:NH4HCO3![]() NH3↑+H2O↑+CO2↑。
NH3↑+H2O↑+CO2↑。
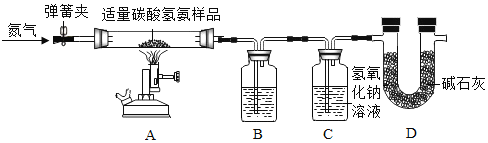
部分实验步骤如下:
Ⅰ.打开弹簧夹,通入一段时间的氮气;
Ⅱ.关闭弹簧夹,给碳酸氢铵样品加热;
Ⅲ.当样品反应完全,…,再停止加热,直到玻璃管冷却;
Ⅳ.实验完毕,测得装置B、C中药品的质量分别增加了m1、m2
请回答下列问题:
(1)NH4HCO3属于______(选填“氮肥”“磷肥”“钾肥”或“复合肥”),装置B中盛放的液体是______,装置D的作用是______。
(2)装置C中发生反应的化学方程式为______。
(3)步骤Ⅲ中,停止加热前应进行的操作是______。
(4)该样品中碳酸氢铵的质量分数的表达式为______(用m1、m2的代数式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列属于复分解反应的是( )
A.2H2O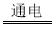 2H2↑+O2↑B.CO+CuO
2H2↑+O2↑B.CO+CuO![]() Cu+CO2
Cu+CO2
C.NaOH+HCl=NaCl+H2OD.Fe+CuSO4=Cu+FeSO4
查看答案和解析>>
科目:初中化学 来源: 题型:
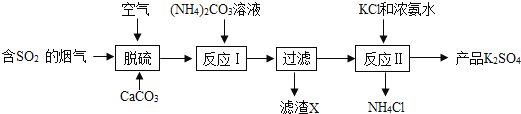
【题目】某热电厂用脱硫方法得到CaSO4生产K2SO4的工艺流程如下。
(资料)碳酸铵在水溶液中温度高于70℃时开始分解。
请回答下列问题:
(1)脱硫反应中的碳酸钙需要粉碎其目的是_____;
(2)脱硫过程的化学方程式为:2CaCO3+2SO2+O2+4H2O=2CaSO42H2O+2X;X的化学式是_____;
(3)反应Ⅰ的温度需要控制在60~70℃,其原因为_____;
A 60~70℃反应速率较快
B 高于70℃时碳酸铵分解,降低了原料的利用率
(4)过滤过程中所需玻璃仪器;烧杯、玻璃棒、_____。若过滤后液体仍然浑浊应_____;滤渣X的化学式为_____;将NH4Cl溶液通过_____、降温结晶、过滤、洗涤、干燥等操作步骤得副产物NH4Cl晶体;
(5)(NH4)2SO4与KCl溶液需在浓氨水中发生反应Ⅱ,析出K2SO4晶体,该反应的化学方程式是_____其中浓氨水的作用是_____;
(6)下列洗涤产品K2SO4晶体的方法中,你认为最好的方法是_____。
A 常温时蒸馏水洗
B 冰水洗
C 饱和硫酸钾溶液洗
(7)检验硫酸钾晶体是否洗涤干净的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某实验小组的同学绘制的两种固体物质的溶解度曲线图。请你根据图示回答问题:
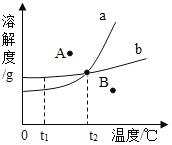
(1)t1°C 时,a 物质的溶解度__________(填“>”、 “<”或 “=”)b 物质的溶解度。
(2)将 t2°C 时相同质量的 a、b 两种物质的饱和溶液分别冷却到 t1°C,析出晶体较多的是_________物质。
(3)溶解度曲线图中的任何一点都表示溶液的一种特定状态。图中 A、B 两个状态中,溶液属于不饱和状态的是____________(填 A 或 B,下同),溶液属于饱和状态的是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表中,同周期元素的结构和性质呈现一定的规律性变化。下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出)。下列有关说法不正确的是( )
元素 | Na | Mg | ① | Si | P | ② | Cl |
原子的最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
原子半径(10-10m) | 1.86 | 1.60 | 1.43 | ③ | 1.10 | 10.2 | 0.994 |
最高正价最低负价 | +1 | +2 | ④ | +4 -4 | +5 -3 | ⑤ | +7-1 |
A.⑤处的最高正价是+6,最低负价是-2
B.元素①的原子序数是 13,①和②形成的化合物的化学式为 AlS
C.第三周期元素(Na→Cl)的最高正价数等于其原子的最外层电子数
D.③处的数值介于 1.10~1.43 之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com