
| A. | 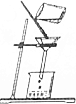 过滤 | B. | 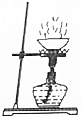 蒸发 | ||
| C. | 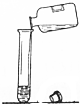 液体的倾倒 | D. | 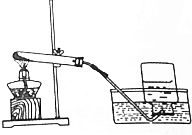 实验室制氧气 |
分析 A、过滤液体时,注意“一贴、二低、三靠”的原则.
B、根据蒸发操作的注意事项进行分析判断.
C、根据向试管中倾倒液体药品的方法进行分析判断.
D、根据实验室制取氧气的制取装置和收集装置,进行分析判断.
解答 解:A、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中所示操作错误.
B、蒸发时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液体飞溅,图中所示操作错误.
C、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中试管没有倾斜、瓶塞没有倒放,所示操作错误.
D、实验室制取氧气,可以采用加热硫酸钾和二氧化锰混合物的方法,属于固体加热型,可用排水法收集,图中所示操作正确.
故选:D.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 分子是保持物质化学性质的一种微粒 | |
| B. | 原子是不能再分的一种微粒 | |
| C. | 离子是构成物质的一种微粒 | |
| D. | 原子失去电子后成阳离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 都是分解反应 | |
| B. | 两者都可用排水法收集 | |
| C. | 都需要加热 | |
| D. | 前者反应物是固体,后者反应物是固体和液体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 保存高铁酸钾时应注意防潮避热 | B. | 高铁酸钾是一种含氧元素的混合物 | ||
| C. | 高铁酸钾中铁元素的化合价为+3价 | D. | 高铁酸钾是一种氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaCO3、KOH、Ca(NO3)2 | B. | Ca(OH)2、BaSO4、MgCl2 | ||
| C. | Na2SO4、AgCl、Ba(OH)2 | D. | NH4Cl、K2CO3、AgNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度 溶解度/g 盐 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 菜肴 | 半小时 | 6小时 | 18小时 | 24小时 |
| 炒青菜 | 0.6861 | 0.7982 | 4.3333 | 5.3624 |
| 韭菜炒蛋 | 1.8153 | 1.9249 | 2.8390 | 5.6306 |
| 红烧肉 | 2.4956 | 4.2558 | 4.3668 | 5.5188 |
| 红烧鲫鱼 | / | 2.0948 | 3.2300 | 7.2397 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com