
分析 碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,由质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出参加反应碳酸钙的质量、生成氯化钙的质量,进而计算出碳酸钙的质量分数、所得溶液的溶质质量分数.
解答 解:(1)由质量守恒定律,反应中生成二氧化碳的质量是10g+90g-97.14g=2.86g.
(2)设参加反应碳酸钙的质量为x,生成氯化钙的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 2.86g
$\frac{100}{44}=\frac{x}{2.86g}$ x=6.5g.
10g蛋壳中碳酸钙的质量分数是$\frac{6.5g}{10g}×$100%=65%.
(3)$\frac{111}{44}=\frac{y}{2.86g}$ y=7.125g
应后烧杯中所得溶液的溶质质量分数是$\frac{7.125g}{6.5g+90g-2.86g}$×100%≈7.6%.
答:(1)反应中生成二氧化碳的质量是2.86g;(2)10g蛋壳中碳酸钙的质量分数是65%;(3)应后烧杯中所得溶液的溶质质量分数是7.6%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.


 天天向上口算本系列答案
天天向上口算本系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
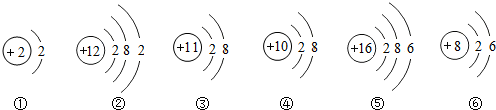
| A. | ①和②化学性质相似 | B. | ②和⑤属于同一周期的原子 | ||
| C. | ①③④具有相对稳定结构 | D. | ①④⑤⑥属于非金属元素的原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物质类别 | 物质名称 | 化学式 | 用途 |
| 酸 | 氯化氢 | HCl | 除铁锈 |
| 碱 | 火碱 | NaOH | 除油污 |
| 碱 | 氢氧化钙 | Ca(OH)2 | 改良酸性土壤 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
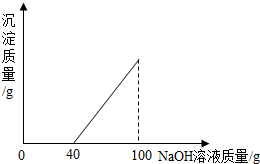 在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.
在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com