
【题目】某兴趣小组欲测定铁矿石中氧化铁的含量,取一定量的矿石粉碎后,用下图方式进行实验,(注意:杂质既不溶于水也不与酸反应,实验过程中物质的损失忽略不计)
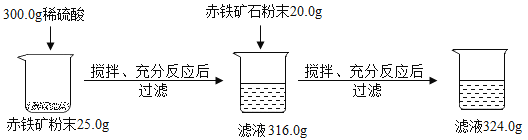
(1)求赤铁矿中氧化铁的质量分数是 。
(2)原300.0g稀硫酸中溶质的质量分数。(写出计算过程,结果保留0. 1%)
【答案】64%;14.7%
【解析】
(1)解:向第一次实验后的316.0g滤液中加入赤铁矿石粉末20.0g,再次过滤,滤液的质量增加了324.0g316.0g=8.0g,第二次加入的赤铁矿石也参加了反应,则第一次反应后稀硫酸有剩余,说明第一次的赤铁矿石粉末25.0g中的氧化铁全部与稀硫酸,25.0g赤铁矿石中的杂质的质量为300.0g+25.0g316.0g=9.0g,赤铁矿中氧化铁的质量分数是![]() ×100%=64%,故填64%。
×100%=64%,故填64%。
(2)解:氧化铁总质量:(20g+25g)×64%=28.8g参加反应的氧化铁的质量为324.0g300.0g=24.0g,300g稀硫酸完全反应。
设参加反应的纯硫酸的质量为x

160:294=24.0g:x
x=44.1g
原300.0g稀硫酸中溶质的质量分数![]() ×100%≈14.7%
×100%≈14.7%
答:原300.0g稀硫酸中溶质的质量分数为14.7%。


科目:初中化学 来源: 题型:
【题目】下列图象分别与选项中的操作相对应,其中不合理的是( )
A.  向一定量的稀醋酸中加入水
向一定量的稀醋酸中加入水
B.  向一定量的锌粉中加入盐酸
向一定量的锌粉中加入盐酸
C.  加热一定量的高锰酸钾固体
加热一定量的高锰酸钾固体
D.  一定温度时向一定量的石灰水中加入氧化钙
一定温度时向一定量的石灰水中加入氧化钙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列分析错误的是
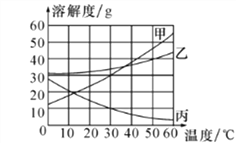
A. 30℃时,把10g丙溶解在50g水中,得到丙的饱和溶液
B. 50℃时,把甲、乙、丙三种溶液降温至10℃,析出晶体的质量由大到小的顺序为:甲>丙>乙
C. 将甲的饱和溶液变为不饱和溶液,可采用升高温度的方法
D. 30℃时,甲的饱和溶液的溶质质量分数约为23.1%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建立宏观与微观之间的联系,是化学学科特有的思维方式。
(1)图中A、B、C、D是四种粒子的结构示意图,E是碘元素在元素周期表中的信息。回答下列问题:
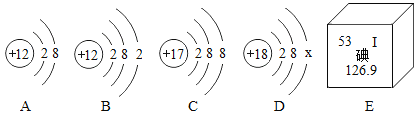
①A、B、C、D四种粒子共表示_______________种元素。
②构成氯化镁的微粒是________________(填字母序号)。
③E中碘元素原子的核内质子数为______________________。
(2)如图是某化学反应微观示意图。在点燃条件下,A和B反应生成C和D。
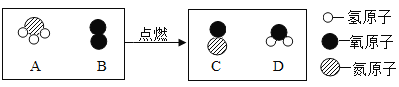
①1个A分子中含有__________个原子。
②A中氮元素和氢元素的质量比为____________________。
③A在B中充分燃烧的化学方程式为____________________。
④生成C与D的质量比是____________________。
(3)请你根据表中信息,类推出丙酸的化学式____________________。
物质名称 | 甲酸 | 乙酸 | 丙酸 | 丁酸 | 戊酸 |
化学式 | CH2O2 | C2H4O2 | ? | C4H8O2 | C5H10O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:

回答下列问题:
(1)生铁属于_____材料(填“合成”或“金属”)。“高炉气体”中的_____(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成 CO 的反应之一为 C + CO2 ![]() 2CO,该反应属于_____反应(填基本反应类型)。
2CO,该反应属于_____反应(填基本反应类型)。
②用化学方程式表示利用 CO 炼铁的原理_____。
③CaCO3 和 SiO2 固体在高温条件下发生反应,生成 CO2 气体和 CaSiO3,该反应的化学方程式为_____。
(3)生活中铁制品锈蚀的过程,实际上是 Fe 与空气中_____、_____等发生化学反应的过程。下列措施能防止铁制品锈蚀的是_____(填标号)。
A 涂油、喷漆 B 镀耐腐蚀的铬层
C 用盐水清洗 D .久置于酸性环境
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)用途广泛,实验室以CuSO4为原料制备Cu2O步骤如下:
预热:分别预热CuSO4溶液和Na2SO3溶液。
反应:在玻璃反应器中混合上述两种溶液,热水浴,搅拌,同时控制反应液pH。
处理:自然冷却后过滤,用蒸馏水洗涤4~5次,在80℃真空干燥箱中烘干,保存产品。
已知:Cu2O在潮湿空气中会逐渐氧化成CuO。
(1)反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
(2)实验中,反应温度、反应液pH对产物中Cu2O%的影响分别如图所示:
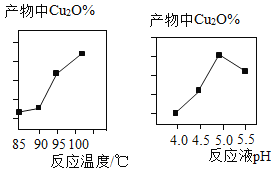
分析图像可知:最佳反应温度为____℃,该反应温度的优点有①____、②____。最佳反应液pH为_,若pH过低,产物中会有Cu杂质,则产物中Cu元素的质量分数将__(填“偏大”或“偏小”或“不变”)。
(3)产品洗净的标准是:取最后一次洗涤液,加入____(填试剂名称)溶液,若无白色沉淀产生,则说明已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是____(填化学方程式)。
(5)工业上用CuSO4·5H2O制备Cu2O,若得到14.40吨Cu2O和一定质量的CuO(假设生产过程中Cu元素无损失),其中Cu2O和CuO的质量比为12:1,计算需要CuSO4·5H2O多少吨?写出计算过程,精确到小数点后两位)____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】太阳能汽车利用太阳能来驱动,真正实现了零排放,有效地减少了对环境的污染,其产业的发展日益蓬勃。从某种意义上讲,太阳能汽车也是电动汽车的—种,所不同的是电动汽车的蓄电池靠工业电网充电,而太阳能汽车用的是太阳能电池。
(1)该太阳能汽车在白天给蓄电池充电的同时行驶,该行驶过程中首先____________能转化为化学能,然后转化为____________ 能,最终转化为机械能。
(2)该汽车车体主体材料是一种密度小、且抗腐蚀性好的一种合金,你认为下列材料中最合适的是___________( 填字母)
A 玻璃钢 B 锰钢 C 硬铝 D 生铁
(3)目前还有一种新能源汽车,氢燃料电池汽车,该种汽车的储氢材料是循环吸放氢过程中生成新的氢化物,其中一种为氢化铝锂(LiAlH4)的氢化物,在 125℃ 时分解为氢气和一种金属单质及氢化锂( LiH )。请你写出氢化铝锂分解反应的化学方程式______________。 反应前后铝元素的化合价分别为 ___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映其对应变化关系的是( )
A. 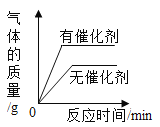 用等质量、等质量分数的过氧化氢溶液制取氧气
用等质量、等质量分数的过氧化氢溶液制取氧气
B. 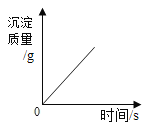 向一定质量的氯化铁溶液中滴加过量的氢氧化钠溶液
向一定质量的氯化铁溶液中滴加过量的氢氧化钠溶液
C. 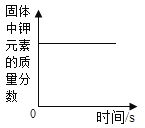 一定质量的高锰酸钾受热分解制取氧气
一定质量的高锰酸钾受热分解制取氧气
D. 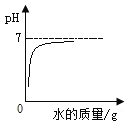 向一定质量分数的稀盐酸中不断加水稀释
向一定质量分数的稀盐酸中不断加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com