
 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:| 样品编号 | ① | ② | ③ | ④ |
| 稀盐酸的质量 | 20g | 40g | m(80<m<130)g | 130g |
| 剩余固体的质量 | 8g | 6g | 2g | 2g |
分析 (1)根据表中的数据分析石灰石样品中杂质的质量,据此可计算出碳酸钙的质量和石灰石样品的纯度;
(2)根据碳酸钠能与氯化钙的反应沉淀写出反应的化学方程式;
(3)根据表中的数据可知,每消耗2gCaCO3需要20g稀盐酸,据此可求出与碳酸钙反应的稀盐酸质量分数和溶质的分数;根据碳酸钙的质量求出与碳酸钙反应的稀盐酸的溶质量的质量,再根据碳酸钠求出与碳酸钠反应的稀盐酸的溶质的质量,最后求出m的质量.
解答 解:(1)由最后两次数据知:最后剩余的2g固体为杂质,所以CaCO3的质量为8g,石灰石样品的纯度为:$\frac{8g}{10g}×100%$=80%;
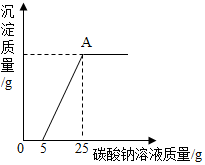
(2)由图象可知,图象中5-25阶段是碳酸钠能与氯化钙的反应生成了碳酸钙沉淀和氯化钠,反应的化学方程式是:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)由表格前两次数据知:每消耗2gCaCO3需要20g稀盐酸,所以8g CaCO3需要消耗盐酸的质量为80g,
设碳酸钙刚好反应完时,消耗HCl x g
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73
8g x
x=5.84g
盐酸的质量分数为:$\frac{5.84g}{80g}×100%$=7.3%
再结合图象可知:当加入5gNa2CO3溶液之前,一直没有沉淀产生,再次说明盐酸过量了
设剩余HCl y g
这个时候发生的反应为:
2HCl+Na2CO3=2NaCl+CO2↑+H2O
73 106
y 5g×10.6%
$\frac{73}{106}=\frac{y}{5g×10.6%}$
解得:y=0.365g
所以编号③所用稀盐酸的质量m为:80g+$\frac{0.365g}{7.3%}$=85g;
故答为:(1)80%;(2)CaCl2+Na2CO3═CaCO3↓+2NaCl;(3)85g.
点评 本题主要考查了化学方程式的计算,难度较大,在计算m的质量时要注意盐酸的质量要包括两部分,一份与碳酸钙发生了反应另一部分与碳酸钠发生了反应.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com