
| 实验编号 | 盐酸的质量分数 | 反应的速度 | 铁锈消失的时间 |
| ① | 6% | 20℃ | 240 s |
| ② | 10% | 20℃ | 115 s |
| ③ | 10% | 30℃ | 75 s |
分析 (1)根据铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水解答;
(2)根据控制变量法进行分析;
(3)根据表格信息来分析;
(4)根据硫酸酸中存在的离子来分析;可根据加入含有硫酸根离子的化合物的溶液观察反应速率快慢来分析;
(5)反应速率的快慢还可能与铁锈和酸的接触面积有关.
解答 解:
(1)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
(2)由表格信息可知,要比较温度对反应快慢的影响,应选择的实验编号是②③;酸的溶质质量分数相同,温度越高,反应时间越短,反应速率越快;
(3)实验①②中盐酸的质量分数不同,温度相同,酸的溶质质量分数越大,反应速率越快;
实验②③中酸的溶质质量分数相同,温度越高,反应时间越短,反应速率越快;
从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快;
(4)硫酸酸中存在氢离子和硫酸根离子,其中加快反应速率的离子是氢离子,故填:H+;
在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用,
(4)铁锈与酸的接触面积也可能会影响反应的速率,故填:将长短相同、粗细不同的两根生锈的铁丝放入等体积、等溶质质量分数的稀盐酸中,观察现象.发现细铁丝表面的铁锈很快就被除去,而粗铁丝表面的铁锈较慢,故可推断出铁锈和酸反应的快慢还与铁锈与酸的接触面积有关.
答案:
(1)Fe2O3+6HCl═2FeCl3+3H2O;
(2)②③;
(3)①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快;
(4)H+;在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用;
(5)将长短相同、粗细不同的两根生锈的铁丝放入等体积、等溶质质量分数的稀盐酸中,观察现象.发现细铁丝表面的铁锈很快就被除去,而粗铁丝表面的铁锈较慢,故可推断出铁锈和酸反应的快慢还与铁锈与酸的接触面积有关.
点评 本题是通过控制不同的量来探究能够影响反应速度的因素的,这类似于物理上所学的控制变量法来解决问题,我们在解答时要注意仔细分析比较,从而得出正确的解答.


科目:初中化学 来源: 题型:解答题
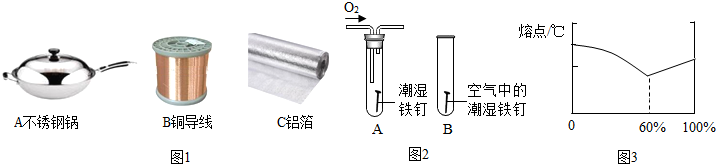
| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 三氯化磷中磷元素的化合价为+3 | |
| B. | 运输过程中如果发生燃烧时,可以用水浇灭 | |
| C. | 运输途中应防雨淋和防高温 | |
| D. | 三氯化磷与水反应的化学方程式:PCl3+3H20═H3PO3+3HCl↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
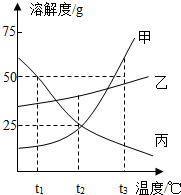 如图是甲、乙、丙三种物质的溶解度曲线.
如图是甲、乙、丙三种物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
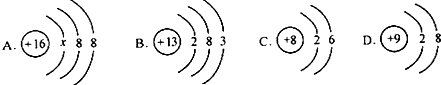
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 苹果、草莓 | B. | 米饭、面条 | C. | 牛肉、豆奶 | D. | 花生、菜籽油 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
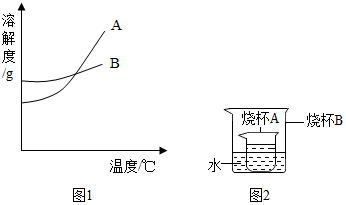 根据下面的溶解度表与溶解度曲线(图1),回答下列问题:
根据下面的溶解度表与溶解度曲线(图1),回答下列问题:| 温度/°C 溶解度/g | 0 | 20 | 40 | 60 | 80 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com