
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生铁的含碳量低于钢 | |
| B. | 为防止钢铁表面生锈,通常要保持其表面的洁净、干燥或涂上保护膜 | |
| C. | 铁跟氧气在点燃的条件下生成黑色的四氧化三铁固体 | |
| D. | 铁与硫酸铜溶液反应,可置换出铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
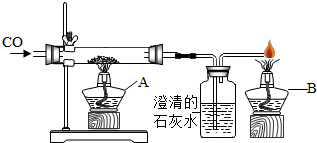 某课外活动小组拟用下列装置做炼铁原理的实验,回答下列问题:
某课外活动小组拟用下列装置做炼铁原理的实验,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 给物质加热时,应把受热物质放在酒精灯的内焰部分 | |
| B. | 给试管里的物质加热时,必须将试管夹从试管的上部往下套夹在试管的中部 | |
| C. | 如果实验时没有说明液体药品的用量,则取用量应不超过试管容积的$\frac{1}{3}$ | |
| D. | 给烧杯里的物质加热时,必须在烧杯底垫上石棉网 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 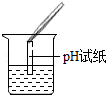 | 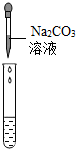 | 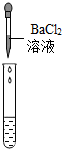 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com