
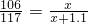
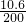 ×100%=5.3%;
×100%=5.3%;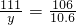
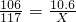 ,
,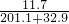 ×100%=5%.
×100%=5%.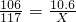


 新课标同步训练系列答案
新课标同步训练系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 | 5 | |
| 金属状态 | 丝状 | 粉末状 | 丝状 | 丝状 | 丝状 | |
| 稀硫酸质量分数/% | 5 | 5 | 10 | 10 | 15 | |
| 溶液温度/℃ | 反应前 | 20 | 20 | 20 | 35 | 丢失数据 |
| 反应后 | 35 | 35 | 35 | 50 | 55 | |
| 金属消失的时间/s | 500 | 50 | 125 | 50 | 30 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?闵行区二模)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
(2013?闵行区二模)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
查看答案和解析>>
科目:初中化学 来源:2011年中考化学模拟冲刺试卷(五)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com