
实验室用98%的浓硫酸(密度为1.84g/ml)配制l00g溶质质量分数为20%的稀硫酸。
(1)配制该溶液的步骤: 、量取、溶解、装瓶贴标签;
(2)溶解过程如右图所示,b中盛放的物质是 ,a的作用是 ;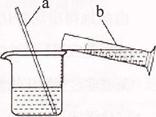
(3)实验过程中如果不慎将浓硫酸沾到皮肤上应立即 , 然后涂上3%—5%的碳酸氢钠溶液;
(4)配制后溶液中溶质的质量分数小于20%,分析引起这一结果的原因可能是 (写出一种即可)。
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 实验室中,用98%的浓硫酸稀释成100g 20%的稀硫酸.根据如图所示的市售浓硫酸的标签,回答下列问题:
实验室中,用98%的浓硫酸稀释成100g 20%的稀硫酸.根据如图所示的市售浓硫酸的标签,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水,充分振荡 | 固体粉末全部溶解 固体粉末全部溶解 |
猜想a、c不成立,猜想b成立. |

| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. |
装置的气密性良好. | |
| ② | 打开分液漏斗活塞,向A 装置中缓慢加入稀盐酸. |
A装置中观察到的现象有 有大量的气泡产生 有大量的气泡产生 ,C装置中有气泡出现. |
A装置中发生反应的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ ;C装置作用是 除去没有反应的二氧化碳 除去没有反应的二氧化碳 . |
| ③ | 一段时间后用带火星的木条在D内进行检验. | 带火星的木条复燃. | 过氧化钠与二氧化碳反应并生成氧气. |

查看答案和解析>>
科目:初中化学 来源:2011-2012年江苏省扬州市宝应县城北初中九年级(下)化学假期作业(6月份)(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2012年江苏省扬州市宝应县城北中学中考化学冲刺试卷(4)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com