


| 样品 | B | D | E | |
| 反应前 | 8g | 350g | 350g | 220g |
| 反应后 | 7.553g | 350.435g | 351.98g | 220.22g |
分析 (1)根据焦炭的性质来分析;
(2)CO具有还原性,能与氧化铁反应而使氧化铁还原成铁,同时放出二氧化碳;
(3)熟记常见仪器的名称;
(4)根据化学反应的原理来分析;
(5)根据实验步骤以及实验中的注意事项来分析解答;
(6)根据装置质量增重的原因来分析;
(7)装置B中浓硫酸吸收氢气与粗还原铁粉反应生成的水,由该装置增重为反应生成水的质量可求得粗还原铁粉中氧元素质量;装置E中碱石灰吸收甲烷与氧化铁反应产生的二氧化碳,由该装置增重为反应生成二氧化碳的质量可计算出粗还原铁粉中所含碳元素质量.
解答 解:(1)焦炭燃烧放出大量的热,产生的热量使装置内其它反应得以发生,还提供了还原剂一氧化碳;故填:①制取CO;②提供热量;
(2)氧化铁在高温条件下能与CO发生反应生成铁与二氧化碳,故填:Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)①是硬质玻璃管,②是铁架台;故填:①硬质粗玻璃管;②铁架台;
(4)铁与稀盐酸反应生成氯化亚铁和氢气,故填:Fe+2HCl=FeCl2+H2↑;
(5)根据题目中的假设情况,为使装置A反应产生的甲烷气体全部在装置C中发生反应,操作时应先将C处酒精灯点燃,然后再点燃A处酒精处;否则会造成测定结果偏小;
步骤③的目的是除去装置内的氧气,防止发生爆炸,验证该步骤目的达到的实验方法是收集尾气靠近燃着的酒精灯,听声音;有剩余则没有完全被除掉;步骤⑥的目的是防止生成的还原铁粉再次被氧化,起保护作用;
故填:④→②;偏小;将装置中的空气排尽,防止点燃时发生爆炸;收集尾气验纯;防止生成的精还原铁粉在高温下又被氧化.
(6)D装置中的浓硫酸能吸收生成的水蒸气,但是氢气还原氧化铁也会生成水蒸气,而装置E增重是因为吸收了反应生成的二氧化碳,也只有此反应生成二氧化碳,所以选择装置E的数据来计算.设生成(220.22g-220g)二氧化碳需要Fe3C的质量为x,由质量守恒定律可知,Fe3C中碳元素的质量与二氧化碳中碳元素的质量相等,则
x×$\frac{12}{56×3+12}×100%$=(220.22g-220g)×$\frac{12}{44}×100%$
x=0.9g
则Fe3C质量分数为$\frac{0.9g}{8g}×100%$=11.25%
故填:E;H2与Fe2O3反应也生成H2O;11.25%;
(7)装置B增重0.435g,则粗还原铁粉与氢气反应生成水的质量为0.435g,生成水中氧元素质量=0.435g×$\frac{16}{18}×100%$≈0.39g
装置E增重0.22g,则甲烷与氧化铁反应生成二氧化碳的质量为0.22g,生成二氧化碳中碳元素质量=0.22g×$\frac{12}{44}$×100%=0.06g
设生成0.2g氢气需要铁的质量为y
Fe+2HCl=FeCl2+H2↑
56 2
y 0.2g
$\frac{56}{2}=\frac{y}{0.2g}$
y=5.6g
8g还原铁粉中含铁5.6g,Fe3C的质量为0.9g,氧元素0.39g,则铁的氧化物中铁元素的质量为:8g-0.9g-0.39g=1.11g
则样品中铁的氧化物中,铁、氧元素的质量比是1.11g:0.39g=111:39.
故填:111:39.
点评 本题考查了常规性的冶炼铁的原理及实验的注意事项等,并在此基础上通过对铁冶炼原理的知识迁移,理解该题的实验过程及目的,考查了知识的运用及实验分析的能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液的碱性不变 | B. | 溶质的溶解度先变大后不变 | ||
| C. | 溶质的质量分数变大 | D. | 溶液中溶质质量不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不慎将浓硫酸沾到皮肤上,应立即用水冲洗,再涂上硼酸溶液 | |
| B. | 药品和仪器的存放应符合一定的规范,氢氧化钠溶液如图存放 | |
| C. | 在实验室里可用品尝的办法区别食盐和蔗糖晶体 | |
| D. | 配制稀硫酸时,可先在烧杯中加入一定量的水,再慢慢注入浓硫酸并不断搅拌 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该物质属于氧化物 | |
| B. | 该物质由碳原子、氢原子和氧原子构成 | |
| C. | 该物质相对分子质量为88g | |
| D. | 该物质中碳、氢、氧元素的质量比为6:1:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 提倡绿色出行,发展公共交通 | |
| B. | 为增加节日气氛,燃放大量鞭炮 | |
| C. | 外出就餐,不因为面子而超量点菜 | |
| D. | 将农作物的秸杆进行深加工,变废为宝,禁止在田地中直接燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
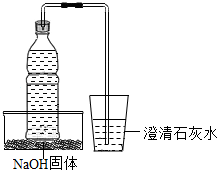 将盛有部分雪碧(碳酸饮料)的饮料瓶的瓶盖上插入一根长吸管,吸管的另一端伸入盛有少量澄清石灰水的杯子里,将饮料瓶放在一装有NaOH固体的容器内,然后向容器内缓缓注入一定量的水,如图所示,请回答:
将盛有部分雪碧(碳酸饮料)的饮料瓶的瓶盖上插入一根长吸管,吸管的另一端伸入盛有少量澄清石灰水的杯子里,将饮料瓶放在一装有NaOH固体的容器内,然后向容器内缓缓注入一定量的水,如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com