为了测定黄铜样品(含铜和锌)中铜的质量分数,取10g黄铜加入到足量的稀硫酸中,使其充分反应,产生氢气0.1g.求该样品中铜的质量分数?
【答案】
分析:因为铜的金属活动性在(H)后,故铜不能与稀硫酸发生置换反应,而锌的活动性在氢前能与硫酸反应生成氢气,利用锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出该黄铜样品中锌的质量;则有样品质量-该黄铜样品中锌的质量=该黄铜样品中铜的质量.
解答:解:(1)设参与反应的锌的质量为x,
Zn+H
2SO
4=ZnSO
4+H
2↑
65 2
x 0.1g
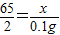
,
解之得:x=3.25g;所以样品中铜的质量是10g-3.25g=6.75g,则样品中铜的质量分数为:
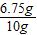
×100%=67.5%
答:该样品中铜的质量分数为67.5%;
点评:本题主要考查了根据化学方程式的计算,要想解答好这类题目,就要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的物质的质量等知识.

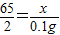 ,
,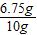 ×100%=67.5%
×100%=67.5%

 阅读快车系列答案
阅读快车系列答案