


 和溶解度曲线回答下列问题:
和溶解度曲线回答下列问题:| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | NaCl | 35.8 | 36.3 | 37.0 | 37.3 |
| KNO3 | 20.9 | 45.8 | 85.5 | 110 | |
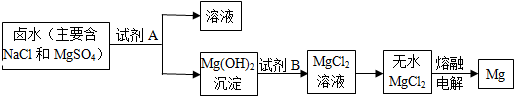
分析 (1)根据碳酸钙在高温的条件下反应生成氧化钙和二氧化碳,碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳进行分析;
(2)根据反应①是氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,反应③是氯化镁在通电的条件下生成镁和氯气进行分析;
(3)①根据硫酸钠的溶解度受温度影响较小进行分析;
②根据60℃时,硝酸钾的溶解度是110g,10℃时,硝酸钾的溶解度是20.9g进行分析.
解答 解:(1)反应①碳酸钙在高温的条件下反应生成氧化钙和二氧化碳,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,反应②是碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)反应①是氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,所以该反应属于复分解反应,反应③是氯化镁在通电的条件下生成镁和氯气,镁元素的化合价发生了改变;
(3)①氯化钠的溶解度受温度影响较小,所以氯化钠的溶解度曲线是乙;
②60℃时,硝酸钾的溶解度是110g,10℃时,硝酸钾的溶解度是20.9g,所以60℃时,100g水中加入90g硝酸钾,充分溶解,所得溶液是不饱和溶液,当60℃的该溶液降温到10℃时,析出晶体的质量为69.1g.
故答案为:(1)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)复分解,③;
(3)①乙;
②不饱和,69.1.
点评 本题难度不大,以“侯氏制碱法”模拟流程图为素材,考查了过滤的原理、化学方程式的书写方法,掌握过滤的原理、化学方程式的书写方法等是正确解答本题的关键.


科目:初中化学 来源: 题型:填空题
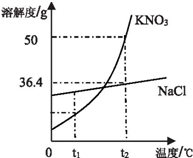 化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性.如图为KNO3和 NaCl两种物质的溶解度曲线.
化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性.如图为KNO3和 NaCl两种物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | A和B的质量比一定等于C和D的质量比 | |
| B. | A和B相对分子质量比为44:36,则C和D的相对发展质量的比也是44:36 | |
| C. | 若A和B各取2g使其反应,则C和D的质量总和一定等于4g | |
| D. | A和B各取2g恰好完全反应,则C和D的质量总和一定等于4g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
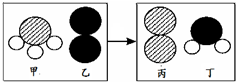 化学是在原子、分子水平上研究物质及其变化的科学.
化学是在原子、分子水平上研究物质及其变化的科学.| 抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
| 有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
| 构成微粒 | Mg2+、OH- | Al3+、Mg2+、OH-、CO32- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 所用氯化钠溶液质量 | 消耗硝酸根溶液质量 | 过滤后的溶液质量 |
| 110g | 147g | 228.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
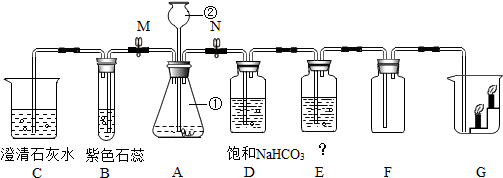
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com