
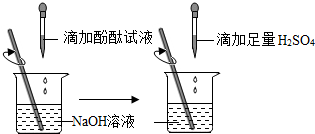
分析 (1)当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此根据氢氧化钠溶液的酸碱性进行分析判断.
根据题意,将一定量稀硫酸加入该氢氧化钠溶液中,混合均匀后测定混合溶液的pH小于7,则可判断出反应后酸过量.
(2)根据碱溶液遇酚酞溶液变红,利用酸碱反发生中和反应使碱减少,据此判断颜色的变化.
(3)方案一是测定溶液的pH来确定溶液酸碱性变化,方案二通过酸碱指示剂的颜色变化确定溶液的酸碱性变化,即都是测定溶液的酸碱性变化来判断反应是否发生.
(4)中和反应为放热反应,根据测定反应前后、过程中溶液的温度变化来确定至少测定的次数.
解答 解:(1)氢氧化钠溶液显碱性,其pH大于7;
(2)将一定量稀硫酸加入该氢氧化钠溶液中,混合均匀后测定混合溶液的pH小于7,说明稀硫酸与氢氧化钠溶液发生了化学反应,且稀硫酸过量.
酚酞溶液滴入到氢氧化钠溶液中显红色,当向氢氧化钠溶液中加入稀硫酸时,发生中和反应反应使碱减少至消失,则红色逐渐变浅直至消失.
(3)无论是测溶液的PH,还是酚酞颜色的变化,都与溶液的酸碱性变化有关.利用pH值,总结上述两个方案在设计思想上的相同点是 测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生了化学反应.
(4)中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测定起始温度,反应中测定温度是否升高,加入过量的硫酸再测定溶液的温度是否降低,故最少需要测定3次.
故答案为:(1)大于;H2SO4;(2)红色逐渐消失;(3)测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生了化学反应;(4)放热;3.
点评 本题有一定难度,考查了中和反应及其应用,掌握中和反应、常见酸碱指示剂的性质、溶液的酸碱性和溶液pH大小之间的关系是正确解题的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 煤气泄漏,应立即关闭阀门并开窗通风 | |
| B. | 为减少“白色污染”,可将塑料垃圾集中焚烧处理 | |
| C. | 木材着火,用水扑灭,是因为降低了木材的着火点 | |
| D. | 启用闲置的沼气池前,先用燃着的蜡烛进行灯火实验 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0个 | B. | l个 | C. | 2个 | D. | 3个 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 物质(括号内为杂质) | 除杂所用试剂和方法 | |
| A | CO2(CO) | 点火燃烧 |
| B | Cu(Zn) | 加入足量稀硫酸,充分反应后过滤 |
| C | NaOH(Na2CO3) | 加入适量稀盐酸,充分反应后蒸发 |
| D | NaCl(Na2SO4) | 加入适量氯化钡溶液,充分反应后过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学小组同学取一定量碳酸钙固体高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究.
化学小组同学取一定量碳酸钙固体高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究.| 实验步骤 | 实验现象 | 实验结论 |
| 取少量剩余固体于试管中,加水 振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 | 猜想Ⅱ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com