
 某同学欲测定实验室一瓶放置已久的烧碱中NaOH的含量,他取适量的烧碱样品,溶于一定量的水得到lOOg溶液.再加入lOOg稀盐酸(足量)充分搅拌到不再放出气泡为止,称量溶液为195.6g.请回答:
某同学欲测定实验室一瓶放置已久的烧碱中NaOH的含量,他取适量的烧碱样品,溶于一定量的水得到lOOg溶液.再加入lOOg稀盐酸(足量)充分搅拌到不再放出气泡为止,称量溶液为195.6g.请回答: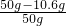 ×100%=78.8%;
×100%=78.8%;

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 某同学欲测定实验室一瓶放置已久的烧碱中NaOH的含量,他取适量的烧碱样品,溶于一定量的水得到lOOg溶液.再加入lOOg稀盐酸(足量)充分搅拌到不再放出气泡为止,称量溶液为195.6g.请回答:
某同学欲测定实验室一瓶放置已久的烧碱中NaOH的含量,他取适量的烧碱样品,溶于一定量的水得到lOOg溶液.再加入lOOg稀盐酸(足量)充分搅拌到不再放出气泡为止,称量溶液为195.6g.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2009年黑龙江省哈尔滨市松北区中考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:
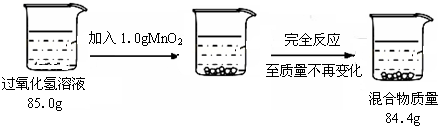
某校兴趣小组的同学欲测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数。
实验测得相关数据如下所示:
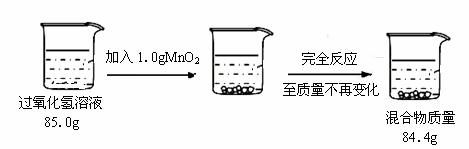
① 反应结束后剩余的 混合物中二氧化锰的质量为 (1) g;生成氧气的质量为 (2) g、物质的量为 (3) mol。
混合物中二氧化锰的质量为 (1) g;生成氧气的质量为 (2) g、物质的量为 (3) mol。
②计算该过氧化氢溶液中溶质质量分数 (4) (通过化学方程式列式计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com