
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐。粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
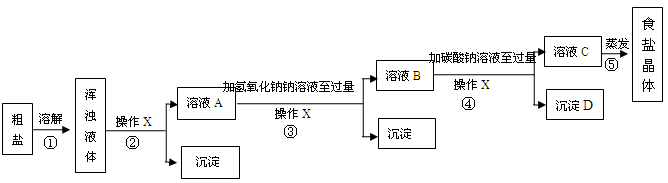
(1)除去粗盐中的难溶性杂质(1分)
除去粗盐中的易溶性杂质CaCl2、MgCl2(1分)
(2)过滤(1分) 漏斗(1分)
(3)MgCl2+2NaOH====Mg(OH)2↓+2NaCl(1分) 不再继续产生沉淀
(4)碳酸钙(或CaCO3)(1分)
(5)氯化钠的溶解度收温度影响较小(1分)
搅拌溶液,避免因局部过热,造成液滴飞溅(1分)
(6)不可行(1分) MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去(1分)
(7)在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3(或在除去Ca2+和Mg2+的同时又引入了新的杂质离子OH—和CO32—)(1分)
(8)向溶液C中逐滴加入稀盐酸至不再产生气泡为止(1分)
解析


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 ,若X等于11,则该微粒表示
,若X等于11,则该微粒表示查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 20℃时,一些物质的溶解度 | ||
| OH- | CO32- | |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com