
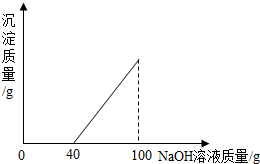
 在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.
在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.分析 (1)根据硫酸会与氢氧化钠发生中和反应,所以在混合溶液中加入氢氧化钠,不会立即生成沉淀进行分析;
(2)根据向硫酸与硫酸铜的混合溶液中滴加氢氧化钠溶液,氢氧化钠先与硫酸反应,待硫酸完全反应后,氢氧化钠与硫酸铜发生反应生成硫酸钠和氢氧化铜沉淀解答;
(3)根据得到的沉淀与所加的氢氧化钠溶液的质量关系图,可查得与硫酸、硫酸铜发生反应的氢氧化钠溶液的质量,根据反应的化学方程式,由消耗氢氧化钠的质量可计算与氢氧化钠反应的硫酸的质量;
(4)根据题中的数据计算溶液的质量和溶质质量,然后计算溶质的质量分数.
解答 解:(1)硫酸会与氢氧化钠发生中和反应,所以在混合溶液中加入氢氧化钠,不会立即生成沉淀;
(2)由得到的沉淀与所加的氢氧化钠溶液的质量关系图,可查得与混合溶液中硫酸发生反应的氢氧化钠溶液质量为40g,当滴加50克氢氧化钠溶液时,硫酸钡全部消耗,混合溶液中的溶质含有硫酸铜和生成的硫酸钠;
(3)(3)设消耗硫酸的质量为x,生成硫酸钠的质量为y
H2SO4+2NaOH═Na2SO4+2H2O
98 80 142
x 40g×40% y
$\frac{98}{x}$=$\frac{80}{40g×40%}$=$\frac{142}{y}$
x=19.6g
y=28.4g
200克混合溶液中,硫酸的溶质质量分数为:$\frac{19.6g}{200g}$×100%=9.8%.
(4)由得到的沉淀与所加的氢氧化钠溶液的质量关系图,可查得与混合溶液中硫酸铜发生反应的氢氧化钠溶液质量为100g-40g=60g,
设生成氢氧化铜沉淀质量为m,生成硫酸钠的质量为n
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 80 98 142
60g×40% m n
$\frac{80}{40%×60g}$=$\frac{98}{m}$=$\frac{146}{n}$
m=29.4g
n=42.6g
反应后溶质的质量分数为:$\frac{42.6g+28.4g}{200g+100g-29.4g}$×100%=25.9%.
故答案为:(1)硫酸会与氢氧化钠发生中和反应;
(2)CuSO4、Na2SO4;
(2)9.8%;
(4)25.9%.
点评 本题主要考查学生的综合分析能力.在处理图象的数据时,注意曲线起点与折点特殊意义的分析,依据物质间反应的情况和图示数据,判断各步反应消耗氢氧化钠溶液的质量.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 学习了质量守恒定律后,小红对此进行了探究.物质发生化学变化的前后,总质量是否发生了变化?通过查阅资料,小红同学已知:碳酸钠与硫酸(H2SO4)反应生成硫酸钠、水和二氧化碳气体.
学习了质量守恒定律后,小红对此进行了探究.物质发生化学变化的前后,总质量是否发生了变化?通过查阅资料,小红同学已知:碳酸钠与硫酸(H2SO4)反应生成硫酸钠、水和二氧化碳气体.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用燃烧法区别羊毛和合成纤维 | |
| B. | 自行车车胎充气过多爆炸 | |
| C. | 以大米、高粱、小麦等粮食为原料酿酒 | |
| D. | 铁制品在潮湿的空气中变成铁锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
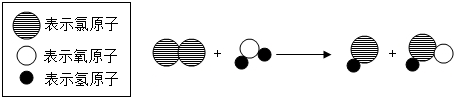
| A. | 图示中共有四种分子 | B. | 此反应类型为中和反应 | ||
| C. | 该反应中氯元素的化合价不变 | D. | 图示不符合质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com