
| 操作 |  甲 | 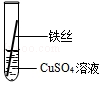 乙 乙 | 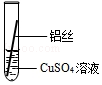 丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | 铝>铁>铜 |
分析 铝比铁活泼,铁比铜活泼,铝能和硫酸铜反应生成硫酸铝和铜;
铁锈主要成分是氧化铁,能和稀硫酸反应生成硫酸铁和水,铁能和稀硫酸反应生成硫酸亚铁和氢气,铝能和稀硫酸反应生成硫酸铝和氢气.
解答 解:【实验探究】
实验过程如下表所示:
| 操作 | 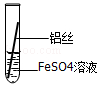 甲 |  乙 乙 |  丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | 铝>铁>铜 |
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:初中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ③⑤ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 通电使水分解 | B. | 高锰酸钾受热分解 | ||
| C. | 氯酸钾加热分解 | D. | 过氧化氢分解 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
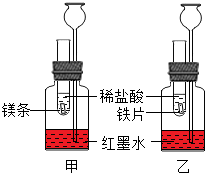 探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.
探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 金属 | 空气 | 稀硫酸 | 硝酸银溶液 |
| 铁 | - | √ | √ |
| 铜 | - | - | √ |
| 镁 | √ | √ | √ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
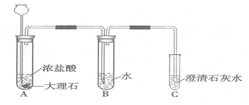 已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题:
已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 倒去部分硝酸钾溶液 | B. | 恒温蒸发掉一部分水 | ||
| C. | 降低溶液的温度 | D. | 加入硝酸钾晶体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 名称 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
| 氯化钠 | 35.8g | 36.0g | 36.3g | 36.6g | 37.0g | 37.3g | 37.8g |
| 硝酸钾 | 20.9g | 31.6g | 45.8g | 63.9g | 85.5g | 110g | 138g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com