
已知X、Y、Z、W、Q都是周期表中短周期的元素,它们的核电荷数依次增大.其中X、Y、Z是同周期的非金属元素.W的三价阳离子与Z的阴离子具有相同的电子层结构,它们相互形成的化合物中存在离子键;XZ2为非极性分子;Y、Z 氢化物的沸点比它们同族其他元素氢化物的沸点高;Q在同周期元素中原子半径最小.
回答下列问题:
(1)写出化合物XZ2的电子式 ,其晶体类型为 .
(2)Y、Z 氢化物的沸点比它们同族元素氢化物的沸点高的原因是 .
(3)将少量YZ2通入过量小苏打溶液中,再使逸出的气体通过装有足量过氧化钠颗粒的干燥管,最后收集到的气体是 .
(4)某温度下,在2L密闭容器中投入0.2mol H2和0.2mol XZ2,发生如下反应:H2+XZ2⇌H2Z+XZ 测得平衡时,XZ2的转化率为60%,则该温度下的平衡常数为 .
(5)高铁酸钾(K2FeO4)是一种新型的高效氧化剂和消毒剂,常用于饮用水处理.工业生产高铁酸钾的方法为:①常温下先将Q的单质通入氢氧化钠溶液中制得含Q元素的一种含氧酸盐;②再将其与氢氧化钠溶液混合氧化硝酸铁,得到高铁酸钠粗产品;③过滤后用氢氧化钾溶液溶解,重结晶,再经过脱碱、洗涤、干燥处理,得到高铁酸钾.写出②中发生反应的离子方程式 ,第③步中高铁酸钠能够转化为高铁酸钾的原因是 .
【考点】原子结构与元素的性质;化学平衡的计算.
【专题】元素周期律与元素周期表专题;化学平衡专题.
【分析】已知X、Y、Z、W、Q都是周期表中短周期的元素,它们的核电荷数依次增大.W的三价阳离子与Z的阴离子具有相同的电子层结构,则W为Al元素;Q原子序数等于W,Q在同周期元素中原子半径最小,则Q为Cl元素;X、Y、Z是同周期的非金属元素,处于第二周期,XZ2为非极性分子,应是CO2,则X为碳元素、Y为氮元素,Z为氧元素.阳离子含有10个电子,与铝离子电子数相同,氧化铝是离子化合物,氨气、水分子间存在氢键,沸点高于同族其他元素氢化物的沸点,验证符合,据此解答.
【解答】已知X、Y、Z、W、Q都是周期表中短周期的元素,它们的核电荷数依次增大.W的三价阳离子与Z的阴离子具有相同的电子层结构,则W为Al元素;Q原子序数等于W,Q在同周期元素中原子半径最小,则Q为Cl元素;X、Y、Z是同周期的非金属元素,处于第二周期,XZ2为非极性分子,应是CO2,则X为碳元素、Y为氮元素,Z为氧元素.阳离子含有10个电子,与铝离子电子数相同,氧化铝是离子化合物,氨气、水分子间存在氢键,沸点高于同族其他元素氢化物的沸点,验证符合,
(1)XZ2是CO2,碳原子与氧原子之间形成2对共用电子对,电子式为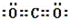 ,其晶体类型属于分子晶体,
,其晶体类型属于分子晶体,
故答案为: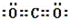 ;分子晶体;
;分子晶体;
(2)氨气分子之间、水分子之间都存在氢键,沸点高于同族其他元素氢化物的沸点,
故答案为:氨气分子之间、水分子之间都存在氢键;
(3)将少量NO2通入过量小苏打溶液中,先与水反应生成硝酸、NO,硝酸与小苏打反应生成二氧化碳,NO、二氧化碳的体积之比为1:2,二氧化碳与过氧化钠反应生成氧气,氧气与NO为1:1,二者反应生成二氧化氮,氧气有剩余,故最后收集到的气体是二氧化氮、氧气,
故答案为:二氧化氮、氧气;
(4)某温度下,在2L密闭容器中投入0.2mol H2和0.2mol CO2,发生如下反应:H2+CO2⇌H2O+CO 测得平衡时,CO2的转化率为60%,则参加反应的二氧化碳为0.2mol×60%=0.12mol,则:
H2(g)+CO2(g)⇌H2O(g)+CO (g),
开始(mol):0.2 0.2 0 0
变化(mol):0.12 0.12 0.12 0.12
平衡(mol):0.08 0.08 0.12 0.12
反应气体气体体积不变,用物质的量代替浓度计算平衡常数,故k= =2.25,
=2.25,
故答案为:2.25;
(5)高铁酸钾(K2FeO4)是一种新型的高效氧化剂和消毒剂,常用于饮用水处理.工业生产高铁酸钾的方法为:①常温下先将氯气通入氢氧化钠溶液中制得含Cl元素的一种含氧酸盐,该盐为NaClO,
②再将其与氢氧化钠溶液混合氧化硝酸铁,得到高铁酸钠粗产品,同时生成氯化钠、水,反应离子方程式为:
3ClO﹣+2Fe3++10OH﹣=2FeO42﹣+3Cl﹣+5H2O,
③由于高铁酸钾的溶解度比高铁酸钠的溶解度小,过滤后用氢氧化钾溶液溶解,重结晶,再经过脱碱、洗涤、干燥处理,得到高铁酸钾,
故答案为:3ClO﹣+2Fe3++10OH﹣=2FeO42﹣+3Cl﹣+5H2O;高铁酸钾的溶解度比高铁酸钠的溶解度小.
【点评】本题综合性较大,涉及结构性质位置关系、常用化学用语、化学平衡及平衡常数的有关计算、氧化还原反应、物质的分离提纯等,难度中等,是对学生综合能力的考查,推断元素是解题的关键.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:初中化学 来源: 题型:
将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象,故此判断三种金属的金属活动性顺序是
A.甲>铜>乙 B.乙>铜>甲 C.铜>甲>乙D.甲>乙>铜
查看答案和解析>>
科目:初中化学 来源: 题型:
按要求写出下列反应的文字表达式或符号表达式
(1)军事上制烟幕弹 ▲ (2)实验室制取二氧化碳的反应 ▲
(3)二氧化碳通入澄清的石灰水 ▲ (4)生成物是氧化物的化合反应 ▲
(5)加热碳酸氢铵 ▲
查看答案和解析>>
科目:初中化学 来源: 题型:
下列实验装置设计正确、且能达到目的是( ) 
A.实验Ⅰ:静置一段时间,小试管内有晶体析出
B.实验Ⅱ:制取O2
C.实验Ⅲ:除CO2气体中的HCl
D.实验Ⅳ:配制一定物质的量浓度的稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室现有一瓶标签被腐蚀的稀盐酸,为测定该盐酸的溶质质量分数,某同
学称取10.6g碳酸钠粉末,向其中逐滴滴加稀盐酸至恰好完全反应,称量反应后所得
溶液的总质量为56.2g。请计算:
(1)生成二氧化碳的质量。
(2)该瓶盐酸的溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com