
【题目】A-H是初中化学常见的物质,其相互转化关系如下图所示,其中A是人体胃液中帮助消化的物质,B是用于改良酸性土壤的碱。
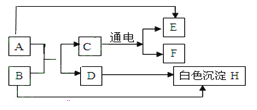
(1)D的化学式为 。
(2)A与B反应的化学方程式为 _________,其反应基本类型属于 ; B转化为H的化学方程式为 ______________________ 。
(3)物质H的一种用途 。
【答案】(1)CaCl2 (2) Ca(OH)2 + 2HCl = CaCl2 + 2H2O 复分解反应
Ca(OH)2 + CO2 = CaCO3↓ + H2O (3) 建筑材料(或补钙剂或治疗胃酸过多)
【解析】
试题分析:框图式的推断题,抓住一些特殊的反应现象、特殊的性质及特殊的反应条件等级题目的“题眼”, 该题的题眼相对较多,A是人体胃液中帮助消化的物质,说明是盐酸;B是用于改良酸性土壤的碱,说明是氢氧化钙,C在通电情况下发生反应,说明是水,那么D自然为氯化钙
(1) D为氯化钙,化学式为:CaCl2
(2) A为盐酸,B为氢氧化钙,两者反应的化学方程式为:Ca(OH)2 + 2HCl = CaCl2 + 2H2O;反应基本类型属于复分解反应;B为氢氧化钙,H 为白色沉淀,可判断为碳酸钙,故B转化为H的化学方程式为:Ca(OH)2 + CO2 = CaCO3↓ + H2O
(3) 物质H为碳酸钙,它的一种用途:建筑材料(或补钙剂或治疗胃酸过多)


科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线.
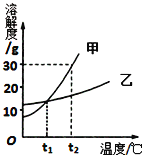
(1)t2℃时,甲物质的溶解度为 ;
(2)分析t1℃时,将10g乙物质放入100g水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液.欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法 .(任填一种方法)
(3)将t1℃时甲和乙的饱和溶液同时升高t2℃,所得溶液中溶质的质量分数的大小关系是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用的制备气体的装置如下图所示,请根据要求完成问题。

① 写出仪器名称:Ⅰ (1) ;Ⅱ (2) ;
② 用氯酸钾和二氧化锰的混合物制取较干燥的氧气可选择的发生和收集装置是 (3) (填装置编号);
③ 制取下列气体可以用启普发生器作为发生装置的是(4) 。
a.双氧水与二氧化锰粉末混合制取氧气
b.实验室制取二氧化碳
c.用锌粒和稀硫酸制取氢气
④ 要制取0.02mol氢气,至少需要多少克锌粒和足量稀硫酸反应?(请根据化学方程式列式计算) (5)
⑤ 从废旧干电池中回收的MnO2含有C,为得到纯净的MnO2并测定MnO2的含量,取该混合物用下图装置进行实验(夹持装置已略去)。

Ⅰ.实验中,用双氧水与二氧化锰混合制取氧气的化学方程式是 (6) ;为得到平稳的氧气流选用的发生装置是 (7) (选填A~G的装置编号)。
Ⅱ.下列数据中可以用来计算样品中MnO2的含量的是 (8)。(假设每步反应均完全且称量准确)
a.反应前后氧气发生装置的质量 b.反应前后装置Ⅰ中固体的质量
c.反应前后装置Ⅱ中固体的质量 d.反应前后装置Ⅲ中固体的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生命活动和生产、生活中起着十分重要的作用。请回答下列问题:
① 在水的净化过程中,常利用 (11) (填物质名称)的吸附性除去水中异味。净化过的水通入氯气后输送到每家每户,其中通入氯气的作用是 (12) 。
② 下表是NaOH和Ca(OH)2的溶解度数据(单位:g/100g水),请回答下列问题。
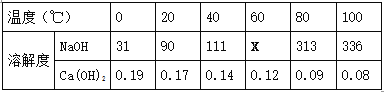
Ⅰ.表示溶解度的符号是 (13) ;表中“111”数字表示的含义是 (14) 。
Ⅱ.为测定X的值,取4份60℃的水各50克,分别进行实验,并记录数据如下表:
实验编号 | 实验1 | 实验2 | 实验3 | 实验4 |
NaOH质量/g | 50 | 60 | 70 | 80 |
H2O质量/g | 50 | 50 | 50 | 50 |
溶液质量/g | 100 | 110 | 114.5 | 114.5 |
【实验结果分析】实验1所得溶液的质量分数为 (15) ;由实验可知X的值为 (16) 。
Ⅲ.除去NaOH溶液中混有的少量Ca(OH)2,通过蒸发浓缩、 (17) ,然后过滤、洗涤、干燥得到NaOH固体。
Ⅳ.现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后,恢复到原来温度得到的溶液(乙溶液),甲、乙溶液中溶质质量甲 (18) 乙(填“>、<、=”)。
Ⅴ.在20℃时,向盛有100g水的烧杯中加入111gNaOH,欲使其完全溶解变成不饱和溶液。下列说法中正确的是 (19) 。
A.溶液的质量可能不变 B.溶质的质量分数一定减小
C.溶液中溶质的质量一定增大 D.可以升温到40℃以上
E.NaOH的溶解度一定变大 F.20℃时加入的水的质量>23.4g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器中加入甲、乙、丙、丁四种物质,在下定条件下发生化学反应,测得反应前及t1、t2时各物质质量如右图所示。下列说法中不正确的是( )

A.该反应为化合反应
B.丙可能为该反应的催化剂
C.该反应中,乙、丁的质量变化之比为7:5
D.该反应中,甲、乙的质量变化之比为1:4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知空气的主要成分是氮气和氧气。某课外活动小组设计了测定空气中氧气含量的实验,实验装置如右图所示。
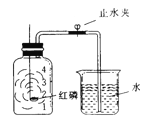
(1)该实验中,红磷需稍过量,目的是: 。
写出该实验中发生的化学反应方程式________________________。
(2)造成测得的氧气体积分数偏小的一种原因是______________。
(3)若将红磷换成炭粉,并在集气瓶中用足量氢氧化钠溶液吸收生成的气体,该实验能否获得成功? (填“能”或“否”)。理由是: ____________________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:

【定性研究】
(1)如图甲,可通过观察_________________来定性比较两者的速率影响效果。
【定量研究】
(2)如图乙,实验前检查该装置气密性的方法是__________________________。要定量比较两者的速率影响效果,可测量生成等体积气体所需的_______________。
【深入研究】
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:___________影响过氧化氢的分解速率;
猜想3:___________影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。 | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。 | 证明是Fe3+影响过氧化氢的分解速率 |
(4)【反思与讨论】上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式___________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组利用硫酸厂的烧渣(主要成分为:铁的氧化物、少量FeS及SiO2),在实验室制备碱式硫酸铁[化学式为Fex(OH)y(SO4)z·nH2O],主要流程如下:
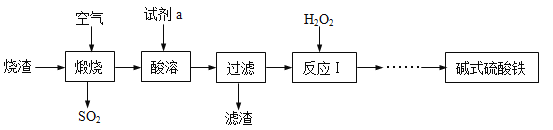
(1)焙烧时产生的二氧化硫可用石灰乳吸收,发生反应的化学方程式为 ,该步骤中用石灰乳而不用澄清石灰水的原因是 。
(2)酸溶时加入的试剂a是 (填化学式),酸溶时发生反应的属于 反应(填基本反应类型)。过滤后获得的滤渣的主要成分是 。
(3)反应l中加双氧水的目的是为了将溶液中的Fe2+氧化为 (填离子符号)。双氧水作为该反应氧化剂的优点是 。
(4)流程中获得碱式硫酸铁[化学式为Fex(OH)y(SO4)z·nH2O]前省略的操作是 ﹑冷却结晶﹑ 和低温烘干。
(5)为确定碱式硫酸铁的化学式,进行了如下实验:
①称取1.692 g碱式硫酸铁样品溶于足量的稀盐酸中并充分混合;
②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、称重,得沉淀2.330 g。
③若向步骤②的滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体0.640g。则碱式硫酸铁[Fex(OH)y(SO4)z·nH2O]样品中的y∶z的值为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com