将65g KMnO4放入试管中加热制取O2,一段时间后,移开酒精灯,待试管冷却后称量试管中剩余固体总质量为58.6g,求:
(1)生成氧气的质量;
(2)参加反应的高锰酸钾的质量.
【答案】
分析:(1)根据质量守恒定律,参加反应的KMnO
4的质量应等于反应后生成的K
2MnO
4、MnO
2和O
2的质量和;所以氧气的质量应等于KMnO
4的质量减去K
2MnO
4、MnO
2的质量.
(2)根据化学方程式以及氧气的质量,列比例式即可求得消耗掉的高锰酸钾的质量.
解答:解:(1)根据质量守恒定律,反应前固体KMnO
4的质量65克,反应后剩余固体是K
2MnO
4、MnO
2,其质量和为58.6g,两质量差即为氧气的质量.即生成氧气的质量为:65g-58.6g=6.4g;
(2))设参加反应的KMnO
4的质量为x.
2KMnO
4
K
2MnO
4+MnO
2+O
2↑
316 32
x g 6.4g

=
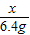
解得 x=63.2g
答:(1)生成氧气的质量为6.4g;
(2)参加反应的高锰酸钾的质量为63.2g.
点评:本题主要考查学生运用质量守恒定律进行分析推断的能力.在运用化学方程式计算时一定要将方程式写正确了.

 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ =
=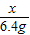 解得 x=63.2g
解得 x=63.2g
