质量守恒定律的定量研究对化学科学发展具有重大作用.
(1)黑火药点燃时发生如下反应:2KNO
3+S+3C
K
2S+3CO
2↑+X↑,其中X的化学式为
N2
N2
.
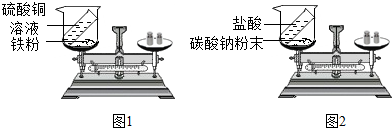
(2)如图1装置中,称量小烧杯及烧杯内所有物质的总质量为m
1,然后将小烧杯中的硫酸铜溶液和铁粉完全混合,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m
2,则(填“=”“>”“<”)m
1=
=
m
2.
(3)如图2装置中,称量小烧杯及烧杯内所有物质的总质量为m
1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m
2,则(填“=”“>”“<”)m
1>
>
m
2,其原因为
因生成的二氧化碳扩散到空气中,依据质量守恒定律,反应前烧杯中反应物的总质量大于使反应后烧杯中剩余物的总质量.
因生成的二氧化碳扩散到空气中,依据质量守恒定律,反应前烧杯中反应物的总质量大于使反应后烧杯中剩余物的总质量.
(4)由此可知,在化学反应前后,一定不变的是
①②⑤⑥
①②⑤⑥
(填序号).
①原子种类 ②原子数目 ③分子种类
④分子数目 ⑤元素种类 ⑥物质的总质量
(5)在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表.则关于此反应的认识不正确的是
B、C
B、C
| 物 质 |
X |
Y |
Z |
W |
| 反应前的质量(g) |
2 |
1 |
16 |
16 |
| 反应后的质量(g) |
17 |
m |
6 |
11 |
A.物质Y可能是该反应的催化剂 B.该反应的基本类型为分解反应
C.参加反应的Z与 W的质量比为2:3 D.反应后容器中Z与Y的质量比为6:1.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案