
| A. | CO2、NH3(氨气) | B. | O2、CO2 | C. | N2、CO2 | D. | NO2、CO2 |
科目:初中化学 来源: 题型:选择题
| A. | 点燃氢气时发生爆炸--点燃前没有检验纯度 | |
| B. | 高锰酸钾制氧气并用排水法收集时,水槽中的水变红--试管口没有略向下倾斜 | |
| C. | 做细铁丝在氧气中燃烧实验时,铁丝没有燃烧--氧气纯度不够 | |
| D. | 制取CO2时,始终收集不到气体--装置气密性不好 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C+2O$\frac{\underline{\;点燃\;}}{\;}$ CO2 | B. | 4Fe+3O2 $\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3 | ||
| C. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2 | D. | 4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$ 2P2O5 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气是一种十分重要的天然资源 | |
| B. | 少量有害气体进入空气中,依靠大自然的自净能力,空气仍能保持洁净 | |
| C. | 空气中可吸入颗粒物的多少不影响人体健康 | |
| D. | 空气中的稀有气体一般不跟其他物质反应,曾被称为“惰性气体” |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酒精洒在桌上燃烧时,立即用湿抹布扑盖 | |
| B. | 可以用嘴吹灭酒精灯 | |
| C. | 进入实验室要注意按照要求做实验 | |
| D. | 实验用剩的药品放入指定容器内 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
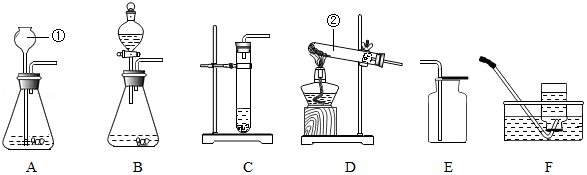
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
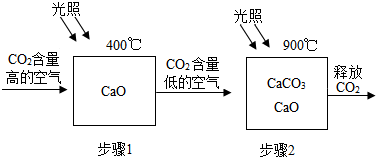
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量固体于试管中,滴加过量稀盐酸溶液. | 试管内有气泡产生. | 分解不完全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com