

分析 (1)据该温度下甲的溶解度分析判断;
(2)据甲乙丙三种物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数计算方法解答;
(3)浓硫酸溶于水放热,丙的溶解度随温度升高而减小.
解答 解:(1)t2℃时甲的溶解度是50g,即100g水中最多溶解50g的甲,所以将10g甲放入10g水中最多溶解5g,得到溶液的质量为15g;
(2)将 t2℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,甲乙的溶解度减小,析出溶质,溶剂的质量不变,溶质的质量分数减小,而丙的溶解度增大,则溶液中溶质、溶剂质量不变,溶质质量分数与降温前相等;饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大则溶质的质量分数大,而t1℃乙的溶解度大于甲的溶解度大于降温前丙的溶解度,故所得溶液中溶质的质分数由大到小的顺序是乙>甲>丙;
(3)将t1℃时,将盛有丙的饱和溶液的小试管放入盛水的烧杯中,向水中缓缓倒入一定量的浓硫酸后,由于浓硫酸溶于水放热,则溶液温度升高,丙的溶解度减小,试管内溶液中有固体析出;
故答案为:(1)15;(2)乙>甲>丙;(3)浓硫酸溶于水,使溶液的温度升高,丙的溶解度减小,从而析出溶质.
点评 了解溶解度概念、溶解度曲线的意义、饱和溶液中溶解度大则溶质的质量分数大、浓硫酸溶于水放热是解答此题的关键.


 天天向上口算本系列答案
天天向上口算本系列答案科目:初中化学 来源: 题型:实验探究题
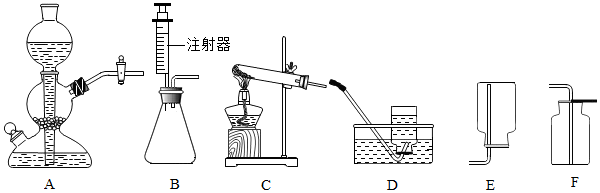
| 药品、实验编号 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
| 目的 | 原料 | 发生装置 | 气体比较平稳产生的最主要一个原因 |
| 制取二氧化碳 | 块状大理石 稀盐酸 | A | |
| 制取氧气 | 粉末状二氧化锰 3%的过氧化氢溶液 | B |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度℃ | 25 | 50 | 95 |
| 溶解度g | 0.17 | 0.95 | 6.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
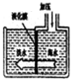 淡水海水可采用膜分离技术(如图),水分子可以透过膜(海水中其他粒子不能透过)进入左侧的池子,从而得到淡水,以下分析中不正确的是( )
淡水海水可采用膜分离技术(如图),水分子可以透过膜(海水中其他粒子不能透过)进入左侧的池子,从而得到淡水,以下分析中不正确的是( )| A. | 这种淡化膜不可用滤纸代替 | B. | 左侧池中的淡水属于软水 | ||
| C. | 右侧池中溶剂的质量不变 | D. | 右侧池中海水的溶质质量分数增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气能支持燃烧,可作燃料 | |
| B. | 水生生物能依靠溶于水中的氧气而生存是由于氧气易溶于水 | |
| C. | 氧气能跟所有物质发生氧化反应,物质在氧气中燃烧的反应一定是化合反应 | |
| D. | 氧气和臭氧(O3)都是氧元素形成的单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳酸钠溶液使石蕊溶液变红 | B. | 溶液pH由8变到11,其碱性减弱 | ||
| C. | 胃酸过多的人应少饮用苹果汁 | D. | 溶液pH由5变到2,其酸性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com