
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 加稀盐酸的质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
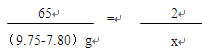
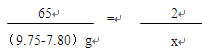


 小学教材全测系列答案
小学教材全测系列答案科目:初中化学 来源:不详 题型:计算题
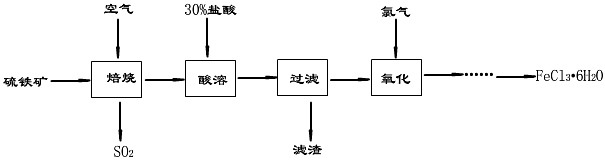
 2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?
2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 执行标准:GB1413-99 主要成分:碳酸钙 含钙量:每片含钙0.75g 每瓶50片,重40 g (中外合资xx公司出品) |
| 物质的质量 | 第一次 | 第二次 | 第三次 | 平均值 |
| 反应前:烧杯+盐酸 | 22 g | 22 g | 22 g | 22 g |
| 10片钙片 | 8 g | 8 g | 8 g | 8 g |
| 反应后:烧杯十剩余物 | 26.7 g | 26.5 g | 26.9 g | 26.7g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
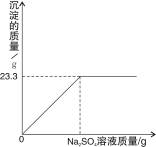
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com