
(6分)取碳酸钠和氯化钠的白色固体混合物l4.6g,与68.3g一定质量分数的稀盐酸混合,恰好完全反应,所得溶液的质量为78.5g。试计算:
(1)生成气体的质量;
(2)反应后所得溶液中溶质的质量分数。
解:(1)气体的质量=14.6g+68.3g-78.5g=4.4g……………………………1分
(2)设混合物中Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3+2HCl = 2NaCl+H2O+CO2↑…………………………l分
106 117 44
x y 4.4g
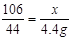 x = 106.g………………………………………1分
x = 106.g………………………………………1分
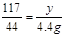 y = 11.7g………………………………………1分
y = 11.7g………………………………………1分
NaCl的总质量=(l4.6g-10.6g)+11.7g=15.7g……………………… 1分
反应后溶液中溶质质量分数为: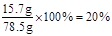 ………………l分
………………l分
答:生成气体的质量为4.4g,反应后所得溶液中溶质质量分数为20%。
(其他合理解法比照记分)
解析:略


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:2013届江苏省扬州市宝应县九年级中考网上阅卷适应性调研(一模)化学试卷(带解析) 题型:探究题
某校化学兴趣小组参观碱式碳酸镁的生产后,知道了以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的主要流程如下:

【问题讨论】
(1)上述流程中滤液的主要溶质(写化学式) ,检验其中阳离子要用的试剂有(填序号) 。
A. 氧化钙 B. 稀盐酸 C. 紫色石蕊试液 D. 硫酸钠溶液
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为 。
(3)流程中“加热” 这一环节每生成l个分子xMgCO3·yMg(OH)2·zH2O需消耗氨的分子数为 (用代数式)。
(4)判断碱式碳酸镁是否洗涤干净,可以采取向最后的洗出液中滴加(填序号) ,然后观察现象判断。
A. 盐酸和氯化钡的混合液 B. 硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
【组成探究一】
(5)已知高温煅烧碱式碳酸镁得到MgO,用下列装置设计实验测定碱式碳酸镁的组成,装置连接从左到右依次为A→ → →D。
(6)取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g、CO21.76g,通过计算确定碱式碳酸镁的化学式为 。(2分)。
计算过程(3分)
【组成探究二】
(7)有同学对用盐酸有异议,认为用硫酸更好。你的看法是(填序号) ;
A.同意 B. 不同意 C. 不确定
你的理由是 。
(8)称得的溶液质量为 g [提示:可用⑹中数据]
【组成探究三】
更为精确的测量碱式碳酸镁受热分解过程中时间与剩余固体质量,作出如下的坐标图
(9)试回答
①加热时,该晶体开始发生化学变化的时刻是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体为(写化学式) 和MgO的混和物。
③t2~t3时间段固体的化学式为(用含x、y的化学式也算对) 。
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省扬州市宝应县九年级中考网上阅卷适应性调研(一模)化学试卷(解析版) 题型:探究题
某校化学兴趣小组参观碱式碳酸镁的生产后,知道了以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的主要流程如下:


【问题讨论】
(1)上述流程中滤液的主要溶质(写化学式) ,检验其中阳离子要用的试剂有(填序号) 。
A. 氧化钙 B. 稀盐酸 C. 紫色石蕊试液 D. 硫酸钠溶液
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为 。
(3)流程中“加热” 这一环节每生成l个分子xMgCO3·yMg(OH)2·zH2O需消耗氨的分子数为 (用代数式)。
(4)判断碱式碳酸镁是否洗涤干净,可以采取向最后的洗出液中滴加(填序号) ,然后观察现象判断。
A. 盐酸和氯化钡的混合液 B. 硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
【组成探究一】
(5)已知高温煅烧碱式碳酸镁得到MgO,用下列装置设计实验测定碱式碳酸镁的组成,装置连接从左到右依次为A→ → →D。

(6)取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g、CO21.76g,通过计算确定碱式碳酸镁的化学式为 。(2分)。
计算过程(3分)
【组成探究二】
(7)有同学对用盐酸有异议,认为用硫酸更好。你的看法是(填序号) ;
A.同意 B. 不同意 C. 不确定
你的理由是 。
(8)称得的溶液质量为 g [提示:可用⑹中数据]
【组成探究三】
更为精确的测量碱式碳酸镁受热分解过程中时间与剩余固体质量,作出如下的坐标图
(9)试回答

①加热时,该晶体开始发生化学变化的时刻是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体为(写化学式) 和MgO的混和物。
③t2~t3时间段固体的化学式为(用含x、y的化学式也算对) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com