
分析 根据质量守恒定律可知,反应前后物质的总质量不变,在化学反应前后原子个数不变,元素质量不变进行分析.
解答 解:X的质量为:4.6g+8g-4.4g-5.4g=2.8g;
4.6gC2H5OH中含有碳元素质量为:4.6g×$\frac{12×2}{46}$=2.4g,含有氢元素质量为:4.6g×$\frac{1×6}{46}$=0.6g,含有氧元素质量为:4.6g-2.4g-0.6g=1.6g;
水中含有氢元素质量为:5.4g×$\frac{2}{18}$=0.6g,含有氧元素质量为:5.4g-0.6g=4.8g,
二氧化碳中含有碳元素质量为:4.4g×$\frac{12}{44}$=1.2g,含有氧元素质量为:4.4g-1.2g=3.2g,
所以X中含有的碳元素质量为:2.4g-1.2g=1.2g,含有的氧元素质量为:8g+1.6g-4.8g-3.2g=1.6g,
所以原子个数比是:$\frac{1.2g}{12}:\frac{1.6g}{16}$=1:1,所以X是CO.
答案:2.8g; 2C2H5OH+5O2$\frac{\underline{\;点燃\;}}{\;}$6H2O+2CO2+2CO.
点评 本题主要考查学生运用质量守恒定律进行推断的能力,难点在于结合化学式的计算确定物质的组成和书写化学方程式.


科目:初中化学 来源: 题型:选择题
| A. | C的相对原子质量为12 | B. | C位于元素周期表第二周期 | ||
| C. | C核外有两层电子排布 | D. | C最外层有4个电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.8g | B. | 1.6g | C. | 1.8g | D. | 3.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
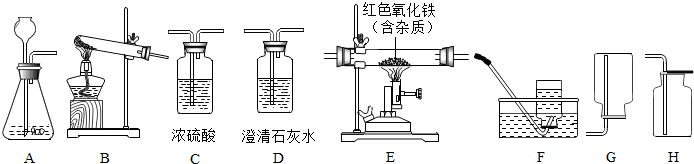
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
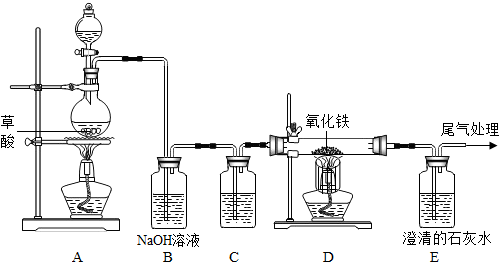
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
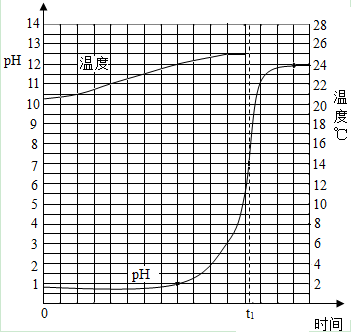
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com