在课堂中,同学们用硫酸、硝酸钡、氢氧化钠、碳酸钾四种物质的溶液,进行复分解反应发生条件的探究.
(1)通过判断上述四种溶液两两之间能否发生反应,写出其中符合下列条件的化学方程式.
有沉淀生成的反应:
H2SO4+Ba(OH)2=BaSO4↓+2H2O
H2SO4+Ba(OH)2=BaSO4↓+2H2O
.
(2)下面图1是HCl和NaOH在水中解离的微观示意图;图2是稀盐酸和氢氧化钠反应的微观过程示意图.
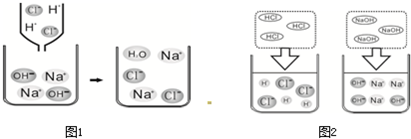
①盐酸和氢氧化钠发生反应的微观实质是什么?
氢离子和氢氧根离子生成水分子或H++OH-=H2O
氢离子和氢氧根离子生成水分子或H++OH-=H2O
.
②通过课堂上的探究能发现:在溶液中,除了H
+和OH
-不能大量共存外,
Ba2+和SO42-
Ba2+和SO42-
(填两种离子符号)也不能大量共存.
(3)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.
①经测定,该溶液显酸性.则该溶液中一定含有的离子是
K+、NO3-、H+、Na+
K+、NO3-、H+、Na+
.(至少写4种离子符号)
②为验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证.(验证一种离子即可)
| 溶液中可能含有的离子 |
设计实验验证(实验步骤、现象及对应的结论) |
SO42- SO42- |
加入硝酸钡溶液,若有沉淀则含有该离子 加入硝酸钡溶液,若有沉淀则含有该离子 |
(4)100g稀盐酸恰好跟100g溶质质量分数为16%的氢氧化钠溶液完全反应,求所得溶液中溶质的质量分数.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案